
Back Amidiny Czech Amidine German Amidine English Amidina Spanish آمیدین FA Amidiinit Finnish Amidine French Amidinek Hungarian アミジン Japanese അമീഡിനുകൾ Malayalam
Le ammidine sono una classe di composti chimici formalmente derivanti dagli ossoacidi.
Gli ossoacidi da cui derivano le ammidine devono essere della forma RnE(=O)OH. Il gruppo ossidrile è sostituito da un gruppo amminico [–NR2], mentre il gruppo [=O] è sostituito dal gruppo imminico [=NR], per cui la struttura generale delle ammidine è RnE(=NR)NR2.[1][2][3]
Le ammidine, a differenza degli ossoacidi da cui derivano, sono composti spiccatamente basici:[4] in seguito a protonazione sull'azoto imminico lo ione positivo risultante, lo ione ammidinio, è efficacemente stabilizzato per risonanza, descrivibile in forma schematica come segue:[5]
- HRN+=E–NR2 ←→ HRN–E=N+R2
In tal modo, dalle ammidine si ottiene una prima serie di sali, come ad esempio i cloruri di ammidinio, per reazione con acido cloridrico: [HRN=E–NR2]+Cl–.
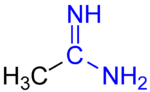
Quando l'acido da cui deriva l'ammidina è un acido carbossilico, il composto risultante è detto carbossiammidina, e ha struttura generale:
Le carbossiammidine vengono chiamate semplicemente ammidine, anche perché sono il tipo di ammidine incontrate principalmente nella chimica organica. L'ammidina più semplice è la formammidina, la cui formula è HC(=NH)NH2.
Altri esempi di ammidine sono l'acetammidina (dall'acido acetico), la benzammidina (dall'acido benzoico), l'ammidina biciclica DBU[6] e il farmaco diminazene.
Il processo più comune per ottenere le ammidine è la reazione di Pinner.
- ^ amidines, su goldbook.iupac.org, p. 1315.
- ^ IUPAC Gold Book - carboxamidines
- ^ IUPAC Gold Book - sulfinamidines
- ^ Clayden, J., Greeves, N., Warren, S. e Wothers, P., Organic Chemistry, Oxford University Press, 2001, p. 202, ISBN 0-19-850346-6.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, p. 69.
- ^ 1,5-diazabiciclo[5.4.0]undec-7-ene.
