
Back سيتوكروم سي أكسيداز Arabic Citocrom c oxidasa Catalan Cytochrom c oxidáza Czech Cytochrome c oxidase English Citocromo c oxidasa Spanish سیتوکروم اکسیداز سی FA Cytochrome c oxydase French Citocromo c oxidase GL Citokróm c-oxidáz Hungarian Sitokrom c oksidase ID
| Cytochrom-c-Oxidase | ||
|---|---|---|
| ||
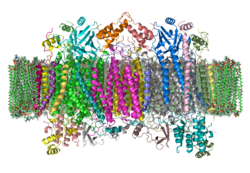
| Bändermodell eines Cytochrom-c-Oxidase-Dimers vom Rind in der Membran nach PDB 1OCC | ||
| Transporter-Klassifikation | ||
| TCDB | 3.D.4.7.1 | |
| Bezeichnung | protonenübertragende COX | |
| Enzymklassifikation | ||
| EC, Kategorie | 1.9.3.1, Oxidoreduktase | |
| Reaktionsart | Redoxreaktion | |
| Substrat | 4 Cytochrom c (reduziert) + O2 + 8 H+(in) | |
| Produkte | 4 Cytochrom c (oxidiert) + 2 H2O + 4 H+(out) | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
| Übergeordnet |
|---|
| Atmungskette-Komplex |
| Gene Ontology |
| QuickGO |
Das Enzym Cytochrom-c-Oxidase (COX), genauer Cytochrom c: Sauerstoff-Oxidoreduktase (systematischer Name), Cytochrom-aa3-Komplex oder auch Komplex IV der mitochondrialen Atmungskette („Zellatmung“) genannt, ist eine früher als Atmungsferment bezeichnete Oxidoreduktase. Der bei Bakterien aus drei, bei Eukaryoten aus dreizehn Untereinheiten bestehende Enzymkomplex katalysiert in einer gekoppelten Reaktion die Oxidation von Cytochrom c mit der Reduktion von Sauerstoff zu Wasser und dem Transport von Protonen über eine biologische Membran.
Mutationen in den Genen, die für die einzelnen Untereinheiten codieren (MT-CO1, MT-CO2, MT-CO3) können seltene Erbkrankheiten verursachen, die unter Cytochrom-c-Oxidasemangel (MT-C4D) zusammengefasst werden, nämlich Optikus-Neuropathie Typ Leber (LHON), rekurrente Myoglobinurie, sowie mitochondriale nichtsyndromale sensorineurale Schwerhörigkeit.[1][2][3]
Die Cytochrom-c-Oxidase gehört zur Superfamilie der Häm-Kupfer-Oxidasen, die bei allen aerob atmenden Organismen den terminalen Elektronenakzeptor der Atmungskette darstellen. Sie sind für nahezu sämtlichen Sauerstoffverbrauch der atmenden Organismen verantwortlich. Die Oxidasen sind bei Eukaryoten in der inneren Mitochondrienmembran, bei Prokaryoten in der inneren Zellmembran eingelagert. Varianten der Cytochrom-c-Oxidase kommen in der Zellmembran aerober Bakterien vor. Diese enthalten zum Teil modifizierte Kofaktoren (Häm-Varianten), oder verwenden andere Elektronendonoren als Cytochrom c (Chinol-Oxidasen z. B. in Escherichia coli). Sie besitzen sämtlich große strukturelle und funktionelle Homologie und enthalten im aktiven Zentrum eine Häm-Gruppe und ein Kupfer-Ion.
Erste bedeutende Studien über die Atmungsfermente und die Zellatmung führte ab 1908 Otto Warburg durch.[4]
- ↑ Eintrag zu Leber-Optikusneuropathie, hereditäre. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 4. Oktober 2010.
- ↑ Eintrag zu Myoglobinurie, rekurrente, genetisch bedingte. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 4. Oktober 2010.
- ↑ Mitochondrially inherited nonsyndromic sensorineural deafness. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 55.