Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Glycerinaldehyd-3-phosphat-Dehydrogenase
| Glyceraldehyd-3-Phosphat-Dehydrogenase | ||
|---|---|---|
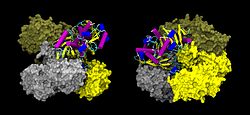
| ||
| Oberflächen-/Bändermodell des GAPDH-Tetramer, nach PDB 1U8F | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 334 aa; 35,9 kDa | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | PRKCI, Sulfat | |
| Bezeichner | ||
| Gen-Namen | GAPDH ; GAPD | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.2.1.12, Oxidoreduktase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | D-Glyceraldehyd-3-phosphat + Phosphat + NAD(+) | |
| Produkte | 3-Phospho-D-glyceroylphosphat + NADH | |
| Vorkommen | ||
| Homologie-Familie | CLU_030140_0_3 | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Huhn | |
| Entrez | 2597 | 374193 |
| Ensembl | ENSG00000111640 | ENSGALG00000014442 |
| UniProt | P04406 | P00356 |
| Refseq (mRNA) | NM_002046 | NM_204305 |
| Refseq (Protein) | NP_002037 | NP_989636 |
| Genlocus | Chr 12: 6.51 – 6.52 Mb | Chr 1: 80.09 – 80.09 Mb |
| PubMed-Suche | 2597 | 374193
|
Die Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH, Syn. 3-Phosphoglycerinaldehyd-Dehydrogenase) ist ein Enzym der Glycolyse und daher unentbehrlich für alle Lebewesen. Sie katalysiert die Umwandlung von Glycerinaldehyd-3-phosphat zu 1,3-Bisphosphoglycerat. Bei dieser Reaktion wird eine energiereiche Phosphat-Bindung aufgebaut, die im folgenden Schritt der Glycolyse auf ADP übertragen wird, wodurch ATP entsteht. Außerdem wird in der katalysierten Reaktion ein NAD+ zu NADH/H+ umgewandelt.
Previous Page Next Page
Глицералдехид-3-фосфатдехидрогеназа Bulgarian Gliceraldehid-3-fosfat deshidrogenasa Catalan Glyceraldehyde 3-phosphate dehydrogenase English Gliceraldehído-3-fosfato deshidrogenasa Spanish GAPDH FA Glyseraldehydi-3-fosfaattidehydrogenaasi Finnish Glycéraldéhyde-3-phosphate déshydrogénase French Gliceraldehido-3-fosfato deshidroxenase GL Glicerinaldehid-3-foszfát-dehidrogenáz Hungarian Gliseraldehida 3-fosfat dehidrogenase ID


