Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Hidrazina
| Hidrazina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Hidrazina | ||
| General | ||
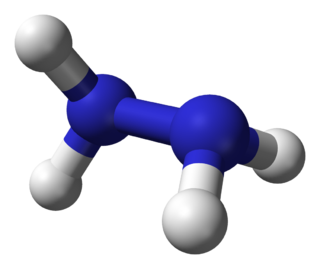
| Fórmula semidesarrollada | NH2-NH2 | |
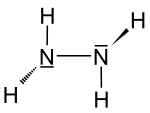
| Fórmula estructural |
 | |
| Fórmula molecular | N2H4 | |
| Identificadores | ||
| Número CAS | 302-01-2[1] | |
| Número RTECS | MU7175000 | |
| ChEBI | 15571 | |
| ChEMBL | CHEMBL1237174 | |
| ChemSpider | 8960 | |
| PubChem | 9321 | |
| UNII | 27RFH0GB4R | |
| KEGG | C05361 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1010 kg/m³; 1,01 g/cm³ | |
| Masa molar | 32,0 g/mol | |
| Punto de fusión | 274 K (1 °C) | |
| Punto de ebullición | 387 K (114 °C) | |
| Propiedades químicas | ||
| Acidez | 8,1±0,01 pKa | |
| Solubilidad en agua | Muy soluble | |
| Termoquímica | ||
| ΔfH0gas | 95,35 kJ/mol | |
| ΔfH0líquido | 50,63 kJ/mol | |
| ΔfH0sólido | 37,63 kJ/mol | |
| S0gas, 1 bar | 238,66 J·mol–1·K | |
| S0líquido, 1 bar | 121,52 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
3
3
3
| |
| Riesgos | ||
| Ingestión | Tóxico, posiblemente un agente cancerígeno. | |
| Inhalación | Muy peligroso, extremadamente destructivo para el tracto respiratorio. | |
| Piel | Puede causar quemaduras severas, puede ser absorbido por la sangre. | |
| Ojos | Puede causar daños permanentes. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La hidrazina o hidracina[3] es un compuesto químico cuya fórmula química condensada es N2H4.
Se trata de un líquido incoloro y oleoso, con un olor similar al del amoníaco y que libera vapores cuando está expuesto al aire. Quema con llama apenas visible. Comercialmente se suministra en disolución acuosa o como hidrato de hidrazina (H2N−NH2 · H2O).
Se utiliza principalmente como espumante para la preparación de espumas poliméricas así como precursor de catalizadores de polimerización y fármacos. Adicionalmente se emplea como combustible para aviones,[4] misiles, cohetes espaciales y satélites. El comburente utilizado en estos casos, habitualmente es el tetrahidruro de dinitrógeno. También se conoce como hidrazinas a los compuestos derivados de esta.
Por norma general la hidrazina no se utiliza como combustible, sino en cambio alguno de sus derivados como la metilhidrazina o la dimetilhidrazina asimétrica. El empleo de estas últimas comporta importantes ventajas, tales como ser almacenables a temperatura ambiente y entrar en combustión en cuanto se ponen en contacto con el comburente (a este tipo de combustibles se les llama hipergólicos). Sin embargo, debido a su alta toxicidad, se ha tendido a abandonar su uso.
Es importante mencionar que este compuesto químico reacciona con el oxígeno de la siguiente manera: N2H4 + O2 → N2 + 2 H2O, reduciendo la posibilidad de corrosión por oxidación en los metales. Además al entrar en contacto con el óxido férrico, genera magnetita, agua y nitrógeno: N2H4 + 6 Fe2O3 → 4 Fe3O4 + 2 H2O + N2.
Theodor Curtius sintetizó por primera vez hidrazina libre en 1889 a través de un tortuoso proceso.[5]
- ↑ Número CAS
- ↑ «Hidrazina, en Cosmos Online». Consultado el 20 de septiembre de 2012.
- ↑ Real Academia Española. «hidracina». Diccionario de la lengua española (23.ª edición). Consultado el 11 de abril de 2021.
- ↑ «Use of Hydrazine in the F16». Consultado el 27 de enero de 2015.
- ↑ Curtius, J. Prakt. Chem. 1889, 39, 107-39.
Previous Page Next Page



