Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Otsoni
| Otsoni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| CAS-numero | |
| PubChem CID | |
| Ominaisuudet | |
| Molekyylikaava | O3 |
| Moolimassa | 47,998 g/mol |
| Ulkomuoto | sinertävä kaasu |
| Sulamispiste | −192,7 °C (80,9 K) |
| Kiehumispiste | −111,9 °C (161,3 K) |
| Tiheys | 2,144 g/dm3 |
| Liukoisuus veteen | 0,105 g / 100 ml |
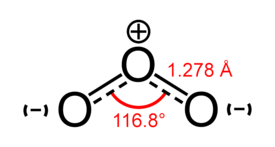
Otsonimolekyylin (O3) muodostaa kolme happiatomia. Se on kaasuna vaalean sinertävää ja nesteenä voimakkaan sinistä. Sen pistävän raikas tuoksu on tuttu ukonilman jälkeen: nimi otsoni tuleekin kreikan hajua tarkoittavasta sanasta (ozein). Otsonin moolimassa on 48,0 g/mol, sulamispiste −193 °C, kiehumispiste −112 °C, liukoisuus veteen 0,1 g / 100 ml 0 °C:n lämpötilassa ja CAS-numero 10028-15-6.
Alkuainehapesta esiintyy lähinnä kolmea allotrooppista muotoa:
- Atomaarinen happi O, atomisäde 74 pm
- Happi O2, sidospituus 121 pm
- Otsoni O3, sidospituus 128 pm
- Lisäksi oletetaan, että nesteessä happea esiintyy O4-muodossa.
Otsoni on diamagneettista, eli sen suhteellinen permeabiliteetti on 1. Otsonin löysi saksalais-sveitsiläinen kemisti Christian Friedrich Schönbein vuonna 1840.
Otsonia muodostuu ilmakehän yläosassa, stratosfäärin otsonikerroksessa, kun auringon ultraviolettisäteily hajottaa happimolekyylejä (O2) happiatomeiksi (O). Nämä sitten yhtyvät molekulaariseen happeen muodostaen otsonia. Otsonia syntyy myös salamoinnin ja kipinöinnin yhteydessä. Otsonikerros suojaa eläviä soluja Auringon ultraviolettisäteilyltä. Absorptio eli säteilyn vaimeneminen perustuu UV-säteilyn kykyyn hajottaa O2- ja O3-molekyylejä.
Koska otsoni on molekyylinä epästabiili verrattuna happikaasuun, se luovuttaa helposti yhden happiatomin ja on siksi hyvä hapetin. Tämän ominaisuuden takia otsonia käytetään muun muassa ilmanpuhdistukseen, vedenpuhdistukseen, valkaisuun ja desinfiointiin. Hengitettynä otsoni vaurioittaa hengitysteitä.
Otsoniin liittyy kaksi ympäristöongelmaa: otsonin väheneminen yläilmakehässä ja otsonin lisääntyminen alailmakehässä. Yläilmakehän otsonikato lisää maan pinnalle tulevan UV-säteilyn määrää. Alailmakehän otsonin lisääntymisellä on puolestaan merkittävä ilmaston lämpenemistä aiheuttava vaikutus[1]. Lisäksi alailmakehän otsoni muodostaa suurina pitoisuuksina terveysriskin etenkin astmaatikoille.
- ↑ Nevanlinna, Heikki (toim.) 2008: Muutamme ilmastoa. Ilmatieteen laitoksen tutkijoiden katsaus ilmastonmuutokseen. Sivu 58.
Previous Page Next Page


