Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Alcool isopropylique
| Alcool isopropylique | |
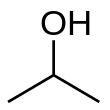  |
|
| Formule topologique et représentation 3D de l'alcool isopropylique | |
| Identification | |
|---|---|
| Nom UICPA | Propan-2-ol |
| Synonymes |
Isopropanol (terminologie impropre[1]) |
| No CAS | |
| No ECHA | 100.000.601 |
| No CE | 200-661-7 |
| DrugBank | DB02325 |
| PubChem | |
| FEMA | 2929 |
| Apparence | liquide incolore[2]. |
| Propriétés chimiques | |
| Formule | C3H8O [Isomères] |
| Masse molaire[4] | 60,095 ± 0,003 3 g/mol C 59,96 %, H 13,42 %, O 26,62 %, |
| pKa | 16,5 (hydrogène du groupe hydroxyle) |
| Moment dipolaire | 1,69 D (gaz)[3] |
| Propriétés physiques | |
| T° fusion | −88,5 °C[3] |
| T° ébullition | 82,5 °C[3] |
| Solubilité | > 10 % dans alcool ; 10 % dans éther ; 10 % dans acétone ; Sol dans le benzène[3] |
| Paramètre de solubilité δ | 23,7 J1/2·cm-3/2 (25 °C)[5] |
| Miscibilité | miscible avec l'eau et la plupart des solvants organiques[3] |
| Masse volumique | 0,78505 [3]
|
| T° d'auto-inflammation | 456 °C[2] ; 399 °C[3] |
| Point d’éclair | 11,7 °C (coupelle fermée)[2] 23,9 °C (coupelle ouverte) (alcool isopropylique à 91 %)[3] |
| Limites d’explosivité dans l’air | inférieure : 2,5 % vol, supérieure : 12,0 % vol[3] |
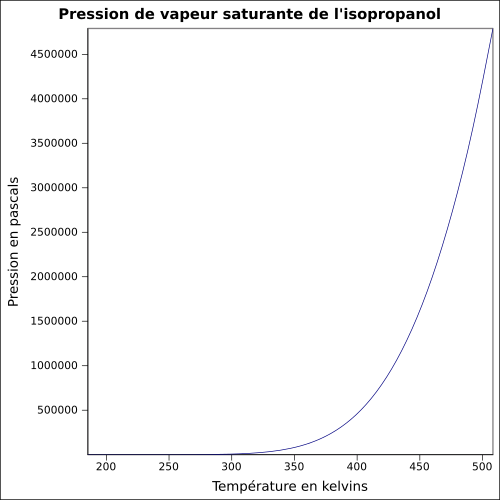
| Pression de vapeur saturante | à 20 °C : 4,4 kPa[2]
|
| Viscosité dynamique | 4,564 6×10-3 Pa·s à 0 °C 2,370 3×10-3 Pa·s à 20 °C 1,331 1×10-3 Pa·s à 40 °C[7] |
| Point critique | 235,15 °C, 5,37 MPa, 0,222 l·mol-1[8] |
| Thermochimie | |
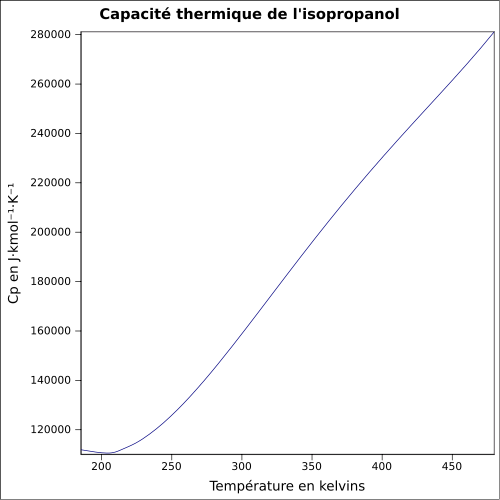
| Cp | |
| PCS | −2 005 kJ·mol-1 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,17 ± 0,02 eV (gaz)[10] |
| Propriétés optiques | |
| Indice de réfraction | 1,3852 ; 1,3802 ; 1,37723 ; 1,3749 [3] |
| Précautions | |
| SGH[13] | |
| H225, H319 et H336 |
|
| SIMDUT[14] | |
  B2, D2B, |
|
| NFPA 704[3] | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] | |
| Inhalation | maux de tête, vertige, dépression mentale, nausée, vomissement, anesthésie et coma |
| Peau | Possibilité d'irritation douloureuse et urticante faible risque de réactions cutanées allergiques rares cas de dermatite de contact allergique |
| Yeux | irritation (sensation de brûlure, rougeurs, larmoiement, voire lésion cornéenne) Possibilité de lésion cornéenne transitoire. |
| Écotoxicologie | |
| DL50 | 3 600 mg·kg-1 (souris, oral) 1 509 mg·kg-1 (souris, i.v.) 4 477 mg·kg-1 (souris, i.p.)[15] |
| CL50 | 16 000 ppm / 8 h (rat, inhalation)[15] |
| LogP | 0,05[2] |
| Seuil de l’odorat | bas : 1 ppm haut : 610 ppm[16] |
| Données pharmacocinétiques | |
| Demi-vie d’élim. | 3 heures |
| Composés apparentés | |
| Isomère(s) | propan-1-ol |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'alcool isopropylique (aussi connu sous le nom non conforme[1] d'isopropanol) est le nom commun du propan-2-ol, composé chimique incolore et inflammable dont la formule chimique est CH3CH(OH)-CH3. C'est l'un des deux isomères du propanol (l'autre étant le propan-1-ol). Il est aussi connu sous son nom abrégé IPA (acronyme de l'anglais IsoPropyl Alcohol).
- « Alcohols Rule C-201.1 ». Nomenclature of Organic Chemistry (The IUPAC 'Blue Book'), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979. "Designations such as isopropanol, sec-butanol, and tert-butanol are incorrect because there are no hydrocarbons isopropane, sec-butane, and tert-butane to which the suffix "-ol" can be added; such names should be abandoned. Isopropyl alcohol, sec-butyl alcohol, and tert-butyl alcohol are, however, permissible (see Rule C-201.3) because the radicals isopropyl, sec-butyl, and tert-butyl do exist."
- ALCOOL ISOPROPYLIQUE, Fiches internationales de sécurité chimique
- « ISOPROPANOL », sur toxnet.nlm.nih.gov, Hazardous Substances Data Bank (consulté le )
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- ↑ Lange's Handbook of Chemistry, 10th ed. pp 1669-1674
- ↑ (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Inorganic Compounds and Elements, vol. 1, Huston, Texas, Gulf Pub. Co., , 384 p. (ISBN 0-88415-857-8)
- ↑ (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- ↑ « propane-2-ol », sur ESIS, consulté le 18 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le )
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ « Alcool isopropylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) « Alcool isopropylique », sur ChemIDplus, consulté le 23 août 2009
- ↑ « Isopropyl alcohol », sur hazmap.nlm.nih.gov (consulté le )
Previous Page Next Page