Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Amidure de sodium
| Amidure de sodium | |
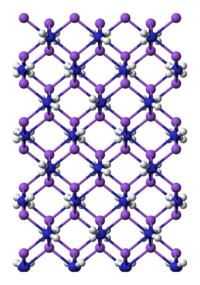
| |
| Amidure de sodium : en bleu, les atomes d'azote, en violet, les sodium et en blanc, les hydrogène | |
| Identification | |
|---|---|
| Nom UICPA | sodium amide |
| No CAS | |
| No ECHA | 100.029.064 |
| No CE | 231-971-0 |
| PubChem | 24533 |
| Apparence | poudre grisâtre, incolore quand elle est pure |
| Propriétés chimiques | |
| Formule | H2NNa |
| Masse molaire[2] | 39,012 3 ± 0,000 3 g/mol H 5,17 %, N 35,9 %, Na 58,93 %, |
| pKa | 38 [1] |
| Propriétés physiques | |
| T° fusion | 210 °C |
| T° ébullition | 400 °C |
| Solubilité | soluble dans l'ammoniac, réagit avec l'eau |
| Masse volumique | 1,39 g·cm-3 |
| T° d'auto-inflammation | 450 °C |
| Point d’éclair | 4,44 °C |
| Cristallographie | |
| Structure type | orthogonal |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'amidure de sodium est le composé chimique de formule brute NaNH2. Ce composé qui réagit violemment avec l'eau, est blanc quand il est pur ; dans le commerce il est typiquement gris, ce qui est dû à la présence d'une petite quantité de fer métallique issue du processus de préparation. De telles impuretés n'affectent généralement pas la réactivité de l'amidure de sodium. NaNH2 est très largement employé en synthèse organique comme base forte.
- ↑ Buncel, Menon; J. Organomet. Chem., 1977, 141, 1
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Previous Page Next Page





