Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Chlorure de zirconium(III)
| Chlorure de zirconium(III) | |
| |
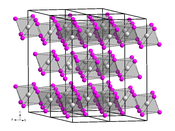
| __ Zr __ Cl Structure cristalline du chlorure de zirconium(III) |
|
| Identification | |
|---|---|
| No CAS | |
| PubChem | 24849755 |
| SMILES | |
| InChI | |
| Apparence | solide bleu marine[1] (isomorphe α) |
| Propriétés chimiques | |
| Formule | Cl3Zr |
| Masse molaire[2] | 197,583 ± 0,008 g/mol Cl 53,83 %, Zr 46,17 %, |
| Propriétés physiques | |
| T° fusion | 627 °C[3] (décomposition à 300 °C[4]) |
| Solubilité | se décompose dans l'eau[4] |
| Masse volumique | 2,28 g/cm3[4] (isomorphe α) 3,05 g/cm3[1] (isomorphe β) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure de zirconium(III) est un composé chimique de formule ZrCl3. Il s'agit d'un solide cristallisé connu par deux isomorphes : une forme α, bleu marine, de structure trigonale avec le groupe d'espace P3m1 (no 164) et les paramètres a = 596,1 pm et c = 966,9 pm, et une forme β, vert olive, de structure hexagonale avec le groupe d'espace P63/mcm (no 193) et les paramètres a = 638,2 pm et c = 613,5 pm[1], avec Z = 2 dans ce cas[5]. Il s'oxyde à l'air libre en chlorure de zirconyle ZrOCl2[4].
Le chlorure de zirconium(III) peut être obtenu en réduisant le chlorure de zirconium(IV) ZrCl4 avec du zirconium[6] ou de l'aluminium (méthode historique[7])[1] :
La synthèse par l'aluminium conduit à la contamination du produit par divers chloroaluminates tels que [Zr(AlCl4)2(AlCl4)2] et Zr(AlCl4)3[8], d'où la prévalence de la méthode directe par le zirconium.
Il est également possible de recourir à un réducteur gazeux pour éviter ces contaminations dans la mesure où les trihalogénures de zinc sont moins volatils. C'est typiquement le cas avec l'hydrogène[9] :
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1354 sqq. (ISBN 3-432-87813-3)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) David R. Lide, « Properties of the Elements and Inorganic Compounds », CRC Handbook of Chemistry and Physics, 90e éd., CRC Press/Taylor and Francis, 2009. (ISBN 978-1-4200-9084-0)
- (de) Jean d’Ans, Ellen Lax et Roger Blachnik, Taschenbuch Fur Chemiker Und Physiker, Springer, 1998, p. 818. (ISBN 3-642-58842-5)
- ↑ (en) Bodie E. Douglas et Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Springer Science+Business Media, 2007, p. 101. (ISBN 978-0-387-26147-8)
- ↑ (en) David M. Hoffman et Samkeun Lee, « Synthesis of pyridine complexes of zirconium(III) chloride and the apparent oxidation to zirconium(IV) by a nitrile », Inorganic Chemistry, vol. 31, no 13, , p. 2675-2676 (DOI 10.1021/ic00039a002, lire en ligne).
- ↑ (de) Otto Ruff et Richard Wallstein, « Reduktion anorganischer Halogenide III.1) Die Reduktion des Zirkontetrachlorids », Zeitschrift für anorganische und allgemeine Chemie, vol. 128, no 1, , p. 96-116 (DOI 10.1002/zaac.19231280110, lire en ligne).
- ↑ (en) E. M. Larsen, James W. Moyer, Francisco. Gil-Arnao et Michael J. Camp, « Synthesis of crystalline zirconium trihalides by reduction of tetrahalides in molten aluminum halides. Nonreduction of hafnium », Inorganic Chemistry, vol. 13, no 3, , p. 574-581 (DOI 10.1021/ic50133a015, lire en ligne).
- ↑ (en) I. E. Newnham et J. A. Watts, « The Preparation of the Anhydrous Zirconium Trihalides », Journal of the American Chemical Society, vol. 82, no 9, , p. 2113-2115 (DOI 10.1021/ja01494a006, lire en ligne).
Previous Page Next Page


