Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Hypochlorite de sodium
| Hypochlorite de sodium | ||
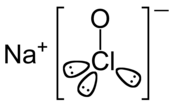
| ||
 | ||
| Structure de l'hypochlorite de sodium | ||
| Identification | ||
|---|---|---|
| Nom UICPA | hypochlorite de sodium | |
| No CAS | ||
| No ECHA | 100.028.790 | |
| No CE | 231-668-3 | |
| PubChem | 23665760 | |
| SMILES | ||
| InChI | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule | NaClO | |
| Masse molaire[1] | 74,442 ± 0,002 g/mol Cl 47,62 %, Na 30,88 %, O 21,49 %, |
|
| Propriétés physiques | ||
| T° fusion | 18 °C | |
| Solubilité | 293 g·L-1 à 0 °C; 799 g·L-1 à 25 °C dans l'eau | |
| Précautions | ||
| SGH[2],[3] | ||
| H314, H400, EUH031, P260, P301, P303, P305, P330, P331, P338, P351, P353, P361, P405 et P501 |
||
| SIMDUT[4] | ||
   C, E, F, |
||
| Transport[3] | ||
| Inhalation | Dangereuse, peut être mortelle | |
| Peau | Irritant, provoque des brûlures, peut être mortel |
|
| Yeux | Irritant, provoque des brûlures | |
| Ingestion | Dangereuse, voire mortelle | |
| intraveineuse | Irritant, provoque des infections | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L’hypochlorite de sodium est un composé chimique de formule brute NaClO. C'est un solide blanc très instable couramment utilisé en solution aqueuse comme agent désinfectant et agent de blanchiment, notamment sous forme d'eau de Javel pour un usage domestique. Sous forme solide anhydre, il tend à se dismuter en oxygène O2, chlorure de sodium NaCl et chlorate de sodium NaClO3 :
Dans l'eau de Javel, l'hypochlorite de sodium est mélangé avec du chlorure de sodium résultant de sa fabrication par l'action du dichlore Cl2 sur une solution d'hydroxyde de sodium NaOH électrolysée entre deux électrodes rapprochée en dessous de 40 °C, afin d'éviter la formation de chlorate de sodium NaClO3 :
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Entrée « Sodium hypochlorite; solution ... percent Cl active » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 13 avril 2011 (JavaScript nécessaire)
- ↑ « Hypochlorite de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
Previous Page Next Page





