Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Etanol
| Etanol | |
|---|---|
|
|
|

|
etanol[1] | |
Outros nomes Alcohol absoluto, alcohol, alcohol etílico, monóxido de etano, EtOH, hidrato etílico, etil hidróxido, etilol, hidroxietano, metilcarbinol | |
| Identificadores | |
| Número CAS | 64-17-5 |
| PubChem | 702 |
| ChemSpider | 682 |
| Ligando IUPHAR | 2299 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C2H6O |
| Masa molar | 46,07 g mol−1 |
| Aspecto | Líquido incoloro |
| Densidade | 0,789 g/cm3 (a 20 °C) |
| Punto de fusión | −114 °C; −173 °F; 159 K |
| Punto de ebulición | 7 837 °C; 14 139 °F; 8 110 K |
| log P | -0,18 |
| Presión de vapor | 5,95 kPa (a 20 °C) |
| Acidez (pKa) | 15.9 (H2O), 29.8 (DMSO)[2][3] |
| Basicidade (pKb) | -1,9 |
| Índice de refracción (nD) | 1,361 |
| Viscosidade | 0,0012 Pa s (a 20 °C), 0.001074 Pa s (a 25 °C)[4] |
| Momento dipolar | 1.69 D[5] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
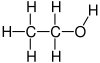
O etanol, ou alcohol etílico, é un composto químico orgánico alifático cun grupo funcional hidroxilo que forma parte da familia dos alcohois. O etanol é o máis común dos alcois. Os alcois son compostos que teñen grupos hidroxilo unidos a átomos de carbono sp3 (é dicir, cadeas de carbono saturadas). A súa fórmula química é CH3-CH2-OH e o seu peso molecular é de 46.0684. En condicións normais de presión e temperatura preséntase como un líquido incoloro cun olor acedo parecido ao do vinagre e é moi inflamable, cun punto de ebulición de 78 °C. Ao mesturarse con auga en calquera proporción, dá unha mestura azeotrópica. Poden considerarse derivados orgánicos da auga nos que un dos hidróxenos foi substituído por un grupo orgánico.
O etanol é unha substancia orgánica obtida a partir da fermentación de azucres, a hidratación do etileno ou a redución do acetaldehído,[6][7] atópase en bebidas como cervexa, viño e licores, así como na industria do perfume.
O etanol obtívose desde a antigüidade[8] por medio de procesos fermentativos de azucres simples, podendo ser inxerido e comportándose fisioloxicamente como unha substancia psicoactiva. Máis tarde, no século XIX, fenómenos como a industrialización ampliaron aínda máis este mercado, que alcanzou un protagonismo definitivo, ao mesmo ritmo que o desenvolvemento da sociedade de consumo no século XX. O seu uso é moi amplo: en bebidas alcohólicas, na industria farmacéutica, como disolvente químico, como combustible ou mesmo como antídoto.
O etanol é moi importante no ámbito médico, onde se utiliza, como outros alcois tamén, no exterminio da vida microbiana nociva, que podería empeorar o estado dos pacientes xa que o etanol mata os organismos denaturalizando as súas proteínas e disolvendo lípidos sendo eficaz contra a maioría de bacterias, fungos e varios tipos de virus, pero é ineficaz contra as esporas bacterianas.[9][10] e conservación de líquidos[11]. Tamén se utiliza na produción de biodiésel, onde reacciona co aceite de rícino.
É o principal produto das bebidas alcohólicas, como o viño (con arredor dun 13 % V/V), a cervexa (entre un 5 % V/V e un 8 % V/V), os licores (ata un 50 % V/V) o as augardentes (ata un 70 % V/V).[12]
- ↑ "Ethanol – Compound Summary". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ Ballinger, P., Long, F.A.; Long (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2". Journal of the American Chemical Society 82 (4): 795–798. doi:10.1021/ja01489a008.
- ↑ Arnett, E.M., Venkatasubramaniam, K.G.; Venkatasubramaniam (1983). "Thermochemical acidities in three superbase systems". J. Org. Chem. 48 (10): 1569–1578. doi:10.1021/jo00158a001.
- ↑ Lide, David R., ed. (2012). CRC Handbook of Chemistry and Physics (92 ed.). Boca Raton, FL.: CRC Press/Taylor and Francis. pp. 6–232.
- ↑ Lide, David R., ed. (2008). CRC Handbook of Chemistry and Physics (89 ed.). Boca Raton: CRC Press. pp. 9–55.
- ↑ Freedom Comunicações. "ÁLCOOL GEL: A REVOLUÇÃO". Consultado o 27 de abril do 2023.
- ↑ Ambiente Brasil. "Etanol - O que é?". Arquivado dende o orixinal o 20 de abril de 2010. Consultado o 27 de abril do 2023.
- ↑ William Campbell Ottley, A Dictionary of Chemistry, and of Minerology (1826) see entry "Alcohol"
- ↑ McDonnell G, Russell AD (1999). "Antiseptics and Disinfectants: Activity, Action, and Resistance".". Clin. Microbiol. Rev. 12 (1): 147–79. PMC 88911. PMID 9880479.
- ↑ "IMPORTÂNCIA DO ÁLCOOL NO CONTROLE DE INFECÇÕES EM SERVIÇOS DE SAÚDE" (PDF). Agência Nacional de Vigilância Sanitária. pp. 1;3. Consultado o 27 de abril do 2023.
A asistencia sanitaria enfróntase constantemente a infeccións relacionadas cos procedementos asistenciais, que se traducen nun aumento da gravidade da enfermidade, da duración da hospitalización, da mortalidade e dos custos. O alcol ten propiedades microbicidas coñecidas pola súa eficacia na eliminación dos xermes máis frecuentemente implicados nestas infeccións, sendo indispensable para levar a cabo acciones sinxelas de prevención [...] A concentración recomendada para conseguir unha maior velocidade microbicida con alcol etílico é do 70% en peso e con alcol isopropílico, entre o 60 e o 95% [...].
- ↑ Coffey, Donavyn (2021-09-05). "Why is alcohol used to preserve things?". livescience.com (en inglés). Consultado o 27 de abril do 2023.
- ↑ "Alcohol etílico o etanol" (en castelán). Arquivado dende o orixinal o 14 de novembro de 2014. Consultado o 10 de setembro de 2014.
Previous Page Next Page


