Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Amonijak
| Amonijak | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
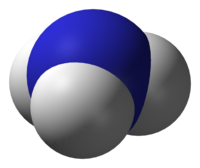 3D prikaz molekule amonijaka
| ||||||||||||||
 Molekula amonijaka
| ||||||||||||||
| IUPAC nomenklatura | Amonijak | |||||||||||||
| Ostala imena | vodikov nitrid duh jelenova roga nitrozil vaporol | |||||||||||||
| Identifikacijski brojevi | ||||||||||||||
| CAS broj | 7664-41-7 ✓ | |||||||||||||
| UN broj | 1005 ✓ | |||||||||||||
| RTECS broj | BO0875000 ✓ | |||||||||||||
| EC broj | 231-635-3 ✓ | |||||||||||||
| PubChem broj | 222 ✓ | |||||||||||||
| Osnovna svojstva | ||||||||||||||
| Molarna masa | 17,0304 g/mol | |||||||||||||
| Izgled | bezbojni plin s jakim oštrim mirisom | |||||||||||||
| Gustoća |
0,6813 g/L | |||||||||||||
| Talište | 195,42 K -77,73 °C | |||||||||||||
| Vrelište | 239,81 K -33,34 °C | |||||||||||||
| Topljivost u vodi | ||||||||||||||
| Dipolni moment |
1,42 D | |||||||||||||
| Struktura | ||||||||||||||
| Oblik molekule | Trigonska piramida | |||||||||||||
| Sigurnosne upute | ||||||||||||||
| ||||||||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||||||||
| Portal:Kemija | ||||||||||||||
Amonijak je spoj dušika i vodika formule NH3. Pri normalnoj temperaturi i tlaku amonijak je bezbojan plin, oštra, karakteristična mirisa, lakši od zraka, lako topljiv u vodi. Otrovan je i korozivan prema pojedinim materijalima. Molekula amonijaka ima trigonsko-piramidalnu strukturu, kao što je i predviđeno teorijom VSEPR-a. Takva struktura daje molekuli amonijaka polarni moment i čini ju polarnom zbog čega se amonijak lako otapa u vodi. Atom dušika u molekuli ima jedan slobodni elektronski par, te se amonijak ponaša kao baza. To znači da amonijak u vodenoj otopini može preuzeti proton od molekule vode čime nastaje hidroksidni anion i jedan amonijev kation (NH4+) koji ima oblik pravilnog tetraedra. Stupanj do kojeg će amonijak stvarati amonijeve ione ovisi o pH vrijednosti otopine - pri vrijednosti pH ~ 7 disocirano je oko 99% molekula amonijaka. Glavna uporaba amonijaka je u proizvodnji gnojiva, eksploziva i polimera. Sastojak je kućnih sredstava za čišćenje. U malim količinama nalazi se u atmosferi, gdje nastaje zbog procesa raspadanja dušičnih tvari životinjskog i biljnog porijekla. Amonijak i amonijeve soli nalaze se u malim količinama u kišnici, dok se amonijev klorid (salmijak) i amonijev sulfat nalaze u blizini vulkana, a kristali amonijevog bikarbonata su pronađeni u patagonskom guanu. Amonijeve soli su rasprostranjene kroz svu plodnu zemlju i u morskoj vodi. Tvari koje sadrže amonijak ili koje su mu slične zovu se amonijakali.
Previous Page Next Page







