Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Fosforna kiselina
| Fosforna kiselina | ||||||||
|---|---|---|---|---|---|---|---|---|
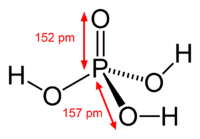 Struktura fosforne kiseline
| ||||||||
 | ||||||||
| IUPAC nomenklatura | Fosforna kiselina | |||||||
| Ostala imena | Ortofosforna kiselina | |||||||
| Identifikacijski brojevi | ||||||||
| CAS broj | 7664-38-2 ✓ | |||||||
| UN broj | 1805 ✓ | |||||||
| RTECS broj | TB6300000 ✓ | |||||||
| EC broj | 231-633-2 X | |||||||
| PubChem broj | 22486802 1004, 22486802 ✓ | |||||||
| Osnovna svojstva | ||||||||
| Molarna masa | 97,994 g·mol−1 | |||||||
| Izgled | Bezbojni sirup | |||||||
| Gustoća | ||||||||
| Talište | 40 – 42,4 °C | |||||||
| Vrelište | 212 °C | |||||||
| Tlak para |
0,03 mmHg (20 °C) | |||||||
| Topljivost u vodi |
Topivo u etanolu | |||||||
| Struktura | ||||||||
 3D model fosforne kiseline
| ||||||||
| Sigurnosne upute | ||||||||
| ||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||
| Portal:Kemija | ||||||||

Fosforna kiselina (točnije ortofosforna kiselina), H3PO4, najvažnija je od mnogih fosforovih kiselina koje sadrže kisik. U bezvodnom stanju to je kristalna tvar tališta 42,35 °C, a koncentrirana vodena otopina (obično 85%-tna) sirupasta je tekućina. Dobiva se izgaranjem bijelog fosfora (ili fosfornih para) i otapanjem nastalog fosforova(V) oksida u vodi, ili reakcijom prirodnih apatita i fosforita sa sumpornom kiselinom. Vodena otopina fosforne kiseline djeluje kao srednje jaka, triprotonska kiselina, pa se od nje odvode tri niza soli: normalni fosfati (PO43-), hidrogenfosfati (HPO42-) i dihidrogenfosfati (H2PO4-). Svi dihidrogenfosfati topljivi su u vodi, a od ostalih su topljivi samo oni alkalijskih metala. Zagrijavanjem na temperaturu višu od 200 °C fosforna kiselina prelazi, uz gubitak vode, u difosfornu (pirofosfornu) kiselinu, H4P2O7 (soli: difosfati ili pirofosfati). Pri još višim temperaturama nastaje trifosforna kiselina i tako dalje, sve do polimerne ravnolančaste polifosforne kiseline (soli: polifosfati), odnosno cikličke metafosforne kiseline (HPO3)n (soli: metafosfati). Ortofosforna se kiselina najviše koristi za proizvodnju svih vrsta fosfata, zatim za dekapiranje (nagrizanje) čelika, proizvodnju sredstava za zaštitu metala od hrđanja, u proizvodnji lijekova i drugo. Jedna je od malobrojnih neškodljivih, neotrovnih kiselina, zato služi i kao sredstvo za zakiseljivanje mnogih bezalkoholnih pića (na primjer Coca-Cole). [3]
- ↑ Christensen, J. H. and Reed, R. B. 1955. Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C. Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061CS1 održavanje: više imena: authors list (link)
- ↑ CAMEO Chemicals Datasheet - Phosphoric Acid
- ↑ fosforna kiselina (točnije ortofosforna kiselina), [1] "Hrvatska enciklopedija", mrežno izdanje, Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, pristupljeno 21. 8. 2020.
Previous Page Next Page





