Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Radon
86Rn Radon | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
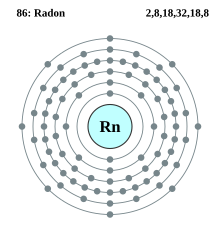 Konfigurasi elektron radon | ||||||||||||||||||||||||||||
Garis spektrum radon | ||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||
| Pengucapan | /radon/[1] | |||||||||||||||||||||||||||
| Penampilan | gas tak berwarna | |||||||||||||||||||||||||||
| Radon dalam tabel periodik | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Nomor atom (Z) | 86 | |||||||||||||||||||||||||||
| Golongan | golongan 18 (gas mulia) | |||||||||||||||||||||||||||
| Periode | periode 6 | |||||||||||||||||||||||||||
| Blok | blok-p | |||||||||||||||||||||||||||
| Kategori unsur | gas mulia | |||||||||||||||||||||||||||
| Nomor massa | [222] | |||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d10 6s2 6p6 | |||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 18, 8 | |||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | gas | |||||||||||||||||||||||||||
| Titik lebur | 202,0 K (−71,15 °C, −96,07 °F) | |||||||||||||||||||||||||||
| Titik didih | 211,5 K (−61,7 °C, −79,1 °F) | |||||||||||||||||||||||||||
| Kerapatan (pada STS) | 9,73 g/L | |||||||||||||||||||||||||||
| saat cair, pada t.d. | 4,4 g/cm3 | |||||||||||||||||||||||||||
| Titik kritis | 377 K, 6,28 MPa[2] | |||||||||||||||||||||||||||
| Kalor peleburan | 3,247 kJ/mol | |||||||||||||||||||||||||||
| Kalor penguapan | 18,10 kJ/mol | |||||||||||||||||||||||||||
| Kapasitas kalor molar | 5R/2 = 20,786 J/(mol·K) | |||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||
| Bilangan oksidasi | 0, +2, +6 | |||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,2 | |||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1037 kJ/mol | |||||||||||||||||||||||||||
| Jari-jari kovalen | 150 pm | |||||||||||||||||||||||||||
| Jari-jari van der Waals | 220 pm | |||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||
| Kelimpahan alami | dari peluruhan | |||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka (fcc) | |||||||||||||||||||||||||||
| Konduktivitas termal | 3,61×10−3 W/(m·K) | |||||||||||||||||||||||||||
| Arah magnet | nonmagnetik | |||||||||||||||||||||||||||
| Nomor CAS | 10043-92-2 | |||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||
| Penemuan | E. Rutherford dan Robert B. Owens (1899) | |||||||||||||||||||||||||||
| Isolasi pertama | W. Ramsay dan R. Whytlaw-Gray (1910) | |||||||||||||||||||||||||||
| Isotop radon yang utama | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Radon adalah sebuah unsur kimia dengan lambang Rn dan nomor atom 86. Ia adalah sebuah gas mulia yang bersifat radioaktif, tak berwarna, tak berbau, dan tak berasa. Ia terjadi secara alami dalam jumlah kecil sebagai perantara dalam rantai peluruhan radioaktif normal di mana torium dan uranium perlahan-lahan meluruh menjadi berbagai unsur radioaktif berumur pendek dan timbal. Radon sendiri merupakan produk peluruhan langsung dari radium. Isotopnya yang paling stabil, 222Rn, memiliki waktu paruh hanya 3,8 hari, menjadikannya salah satu unsur yang paling langka. Karena torium dan uranium adalah dua unsur radioaktif paling umum di Bumi, juga memiliki tiga isotop dengan waktu paruh beberapa miliar tahun, radon akan ada di Bumi jauh di masa depan meskipun waktu paruhnya singkat. Peluruhan radon menghasilkan banyak nuklida berumur pendek lainnya, yang dikenal sebagai "anak radon", berakhir pada isotop timbal yang stabil.[3]
Tidak seperti semua unsur perantara lainnya dalam rantai peluruhan yang disebutkan di atas, radon, dalam kondisi standar, berbentuk gas dan mudah terhirup, sehingga berbahaya bagi kesehatan. Radon seringkali menjadi kontributor tunggal terbesar untuk dosis radiasi latar seseorang, tetapi karena perbedaan lokal dalam geologi,[4] tingkat paparan gas radon berbeda dari satu tempat ke tempat lain. Sumber yang umum adalah mineral yang mengandung uranium di dalam tanah, dan karena itu ia terakumulasi di area bawah tanah seperti ruang bawah tanah. Radon juga dapat terjadi di beberapa air tanah seperti mata air dan mata air panas.[5] Perubahan iklim dapat menyebabkan radon yang sebelumnya terperangkap di bawah tanah dilepaskan sebagai pencairan ibun abadi, terutama di wilayah seperti Kutub Utara, Alaska, Kanada, Greenland, dan Rusia. Dimungkinkan untuk menguji radon dalam bangunan, dan menggunakan teknik seperti depresurisasi sub-lempengan untuk mitigasi.[6][7]
Studi epidemiologi telah menunjukkan hubungan yang jelas antara menghirup radon konsentrasi tinggi dan kejadian kanker paru-paru. Radon adalah kontaminan yang mempengaruhi kualitas udara dalam ruangan di seluruh dunia. Menurut Badan Perlindungan Lingkungan Amerika Serikat (EPA), radon adalah penyebab kanker paru-paru kedua yang paling sering, setelah merokok, menyebabkan 21.000 kematian akibat kanker paru-paru per tahun di Amerika Serikat. Sekitar 2.900 kematian ini terjadi di antara orang yang tidak pernah merokok. Walaupun radon adalah penyebab kanker paru-paru kedua yang paling sering, ia adalah penyebab nomor satu di antara nonperokok, menurut perkiraan berorientasi kebijakan EPA.[8] Ketidakpastian yang signifikan ada untuk efek kesehatan dari paparan dosis rendah.[9] Berbeda dengan radon yang berbentuk gas, anak radon berbentuk padat dan menempel pada permukaan, seperti partikel debu di udara, yang dapat menyebabkan kanker paru-paru bila terhirup.[10]
- ^ (Indonesia) "Radon". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (edisi ke-92). Boca Raton, FL: CRC Press. hlm. 4.122. ISBN 1439855110.
- ^ Toxicological profile for radon Diarsipkan 15 April 2016 di Wayback Machine., Agency for Toxic Substances and Disease Registry, U.S. Public Health Service, In collaboration with U.S. Environmental Protection Agency, Desember 1990.
- ^ Kusky, Timothy M. (2003). Geological Hazards: A Sourcebook. Greenwood Press. hlm. 236–239. ISBN 9781573564694.
- ^ "Facts about Radon". Facts about. Diarsipkan dari versi asli tanggal 22 Februari 2005. Diakses tanggal 12 Maret 2023.
- ^ Baraniuk, Chris (11 Mei 2022). "The race against radon". Knowable Magazine (dalam bahasa Inggris). Annual Reviews. doi:10.1146/knowable-051122-1
 (tidak aktif 31 Desember 2022). Diakses tanggal 12 Maret 2023.
(tidak aktif 31 Desember 2022). Diakses tanggal 12 Maret 2023.
- ^ https://semspub.epa.gov/work/09/2099558.pdf [URL PDF mentah]
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaepa - ^ Dobrzynski, Ludwik; Fornalski, Krzysztof W.; Reszczyńska, Joanna (23 November 2017). "Meta-analysis of thirty-two case–control and two ecological radon studies of lung cancer". Journal of Radiation Research. 59 (2): 149–163. doi:10.1093/jrr/rrx061
 . PMC 5950923
. PMC 5950923  . PMID 29186473.
. PMID 29186473.
- ^ "Public Health Fact Sheet on Radon — Health and Human Services". Mass.Gov. Diarsipkan dari versi asli tanggal 21 November 2011. Diakses tanggal 12 Maret 2023.
Previous Page Next Page




