Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Silicis
| Silicis (Si) | |
|---|---|
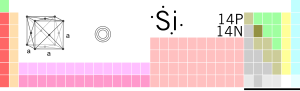
| |
| Periodinė grupė | |
| Atomo numeris | 14 |
| Išvaizda | |
| Atomo savybės | |
| Atominė masė (Molinė masė) |
28,0855 а.m.v. (g/mol) |
| Atomo spindulys |
110 (111) pm |
| Jonizacijos energija (pirmas elektronas) |
786,5 kJ/mol (eV) |
| Elektronų konfigūracija |
[Ne]3s² 3p² |
| Cheminės savybės | |
| Kovalentinis spindulys |
111 pm |
| Jono spindulys |
? pm |
| Elektroneigiamumas |
1,90 (pagal Polingą) |
| Elektrodo potencialas |
N/A |
| Oksidacijos laipsniai |
4 |
| Termodinaminės savybės | |
| Tankis |
2,33 g/cm³ |
| Šiluminė talpa |
700 J/(K·mol) |
| Šiluminis laidumas |
148 W/(m·K) |
| Lydymosi temperatūra |
1687 K |
| Lydymosi šiluma |
50,55 kJ/mol |
| Virimo temperatūra |
3173 K |
| Garavimo šiluma |
384,22 kJ/mol |
| Molinis tūris |
12,06 cm³/mol |
| Kristalinė gardelė | |
| Kristalinė gardelė |
kubinė |
| Gardelės periodas |
N/A Å |
Silicis (lot. silicium) – cheminis elementas periodinėje elementų lentelėje, žymimas Si. Silicio atominis skaičius – 14.
Nors silicis sudaro net 27 % Žemės plutos masės, tačiau gryno gamtoje nerandama. Šis elementas laboratorijoje išskirtas tik 1811 m. Tai tamsiai pilki metališko blizgesio milteliai. Junginiuose silicis yra keturvalentis, jo oksidacijos laipsnis (išskyrus junginius su metalais) lygus +4. Silicis yra šiuolaikinės elektronikos pramonės pagrindas. Be to silicis gali sudaryti silikatus.
Previous Page Next Page



