Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
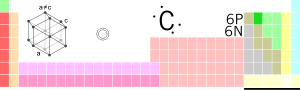
Kohlenstoff
| |||||||||||||||||||||||||
| Allgemeen | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Naam, Teken, Atomtall | Kohlenstoff, C, 6 | ||||||||||||||||||||||||
| Cheemsch Serie | Nichmetall | ||||||||||||||||||||||||
| Klöör | swart (Graphit) ahn Klöör (Demant) | ||||||||||||||||||||||||
| Atommass | 12,0107 u | ||||||||||||||||||||||||
| Elektronenkonfiguratschoon | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| Elektronen je Schaal | 2,4 | ||||||||||||||||||||||||
| Physikaalsche Egenschoppen | |||||||||||||||||||||||||
| Phaas | Faststoff | ||||||||||||||||||||||||
| Dicht | 2,267 (Graphit) 3,513 (Demant) g·cm−3 (bi RT) | ||||||||||||||||||||||||
| Tripelpunkt | 4300-4700 K, 10 MPa | ||||||||||||||||||||||||
| Atomare Egenschoppen | |||||||||||||||||||||||||
| Kristallstruktur | hexagonal | ||||||||||||||||||||||||
| Ionisatschoonsenergien | 1.: 1086,5 kJ/mol | ||||||||||||||||||||||||
| 2.: 2352,6 kJ/mol | |||||||||||||||||||||||||
| 3.: 4620,5 kJ/mol | |||||||||||||||||||||||||
| Atomradius | 70 pm | ||||||||||||||||||||||||
| Annere Egenschoppen | |||||||||||||||||||||||||
| Isotopen (Utwahl) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
De Kohlenstoff (latiensch: Carbonium) is en Element ut dat Periodensystem un tellt to de Nichtmetallen. Dat Atomteken is C un de Atomtall is 6. In de Natur kann Kohlenstoff gediegen oder cheemsch bunnen vörkamen. Dat Kohlenstoffatom wiest en sünnere Anorden vun de Elektronen in de Hüll op, neemlich en halfvulle L-Schaal. Dordör kann Kohlenstoff bannig komplexe Molekülen billn un hett vun all cheemsche Elementen de gröttste Männigkeit vun Verbinnen. Kohlenstoffverbinnen sünd de molekulare Grundlaag vun all Leven op de Eer un stellt dormit ok de Grundlaag dor för de orgaansche Chemie.
Previous Page Next Page