Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
N-butyllithium
| n-butyllithium | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
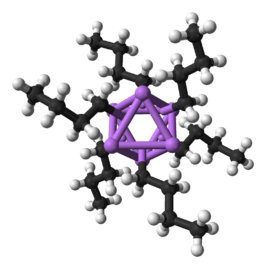
Molecuulmodel van het n-butyllithiumhexameer
| ||||
| Algemeen | ||||
| Molecuulformule | C4H9Li | |||
| IUPAC-naam | n-butyllithium | |||
| Andere namen | NBL, BuLi, nBuLi 1-lithiobutaan, tetra-μ3-butyl-tetralithium | |||
| SMILES | CCCC[Li]
| |||
| CAS-nummer | 109-72-8 | |||
| PubChem | 61028 | |||
| Wikidata | Q410875 | |||
| Beschrijving | Kleurloze instabiele vloeistof | |||
| Vergelijkbaar met | s-BuLi, t-BuLi, MeLi, hexyllithium | |||
| Fysische eigenschappen | ||||
| Dichtheid | 0,68 g/cm³ | |||
| Smeltpunt | −76 °C | |||
| Goed oplosbaar in | cyclohexaan, di-ethylether | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | (tetrameer) 0 D | |||
| Evenwichtsconstante(n) | pKa > 35 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||

n-butyllithium (meestal afgekort tot n-BuLi) is het meest gebruikte organolithiumreagens. Het kan rekenen op een wijd toepassingsgebied, zowel in het laboratorium als op industriële schaal. De industrie gebruikt de stof als initiator bij de polymerisatie van 1,3-butadieen of styreen-butadieen-styreen (SBS) tot elastomeren. Daarnaast wordt n-BuLi zowel in de industrie als in het laboratorium als sterke base toegepast.
Commercieel is n-BuLi beschikbaar als oplossing in diverse sterktes: (15%, 25%, 2 tot 10 M). Als oplosmiddel worden n-pentaan, hexanen en heptanen gebruikt. Hoewel oplossingen van n-BuLi in di-ethylether en THF gemaakt kunnen worden, zijn deze niet stabiel genoeg voor opslag.
Hoewel n-BuLi in zuivere vorm een kleurloze vloeistof is, wordt het meestal aangetroffen als een lichtgele oplossing in alkanen. Dergelijke oplossingen zijn bijna oneindig houdbaar, mits op de juiste manier opgeslagen.[1] In de praktijk moet geconstateerd worden dat een langzame ontleding optreedt. Er ontstaat een fijn wit neerslag van lithiumhydride en de kleur verandert langzaam via geel naar oranje.
- ↑ Brandsma, L.; Verkraijsse, H. D. (1987). Preparative Polar Organometallic Chemistry I. Springer-Verlag, Berlin. ISBN 3-540-16916-4.
Previous Page Next Page


