Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Balmerova serija

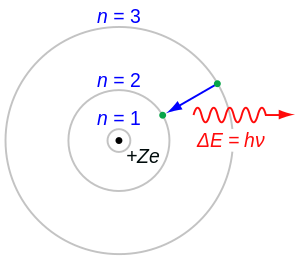

Balmerova serija u atomskoj fizici, prestavlja jednu od emisionih spektralnih linija vodika, koja nastaje skokom elektrona iz viših kvantnih energetskih razina u niže kvantne energetske razine. Balmerovu seriju se može izračunati sa Balmerovom formulom, a to je empirijska formula koju je otkrio Johann Balmer 1885. [1]
Vidljivi dio spektra vodika pokazuje četiri valne duljine: 410 nm, 434 nm, 486 nm i 656 nm, i prestavljaju emisiju fotona, koja nastaje skokom elektrona sa više energetske razine na energetsku razinu 2. Jedan dio Balmerove serije je u ultraljubičastom dijelu spektra, jer je valna duljina manja od 400 nm.
- ↑ C.R. Nave (2006). "HyperPhysics" Hydrogen Spectrum. Georgia State University, 2008.
Previous Page Next Page


