Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
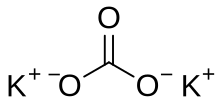
Kalijev karbonat
| |
| |

| |
| Imena | |
|---|---|
| IUPAC ime
kalijev karbonat
| |
| Druga imena
dikalijev karbonat, pepelika, potaša
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| Število E | E501(i) (sredstva za uravnavanje Ph, ...) |
PubChem CID
|
|
| RTECS število |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| K2CO3 | |
| Molska masa | 138,205 g/mol |
| Videz | bela higroskopna trdnina |
| Gostota | 2,43 g/cm3 |
| Tališče | 891 °C (1.636 °F; 1.164 K) |
| Vrelišče | razpade |
| 112 g/100 mL (20 °C) 156 g/100 mL (100 °C) | |
| Topnost | netopen v etanolu, metanolu in acetonu |
| Nevarnosti Napaka v predlogi * neznano ime parametra (Predloga:Chembox Hazards): "ExternalMSDS; NFPA-O; EUIndex" (Glej seznam parametrov). To sporočilo se izpiše le v Predogled, ne bo se izpisalo po Objavi spremembe.
| |
| Glavne nevarnosti | |
| R-stavki (zastarelo) | R22 R36 R37 R38 |
| NFPA 704 (diamant ognja) | |
| Plamenišče | ni vnetljiv |
| Smrtni odmerek ali koncentracija (LD, LC): | |
LD50 (srednji odmerek)
|
1870 mg/kg (peroralno, podgana)[1] |
| Sorodne snovi | |
| Drugi anioni | kalijev bikarbonat |
| Drugi kationi | litijev karbonat natrijev karbonat rubidijev karbonat cezijev karbonat |
| Sorodne snovi | amonijev karbonat |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Kalijev karbonat ali pepelika je bela sol s kemijsko formulo K2CO3. Topen je v vodi in netopen v metanolu.[2] Vodna raztopina je zelo alkalna. Nastaja na primer v reakciji kalijevega hidroksida (KOH) z ogljikovim dioksidom (CO2). Je zelo higroskopen, zato je v trdnem stanju pogosto moker. Uporablja se predvsem za proizvodnjo mila in stekla.
- ↑ Potassium carbonate. Toxnet. Pridobljeno 21. februarja 2015.
- ↑ A.V Kurzin (2002). Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol. Journal of Chemical & Engineering Data 47 (5). DOI: 10.1021/je020012v.
Previous Page Next Page



