Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Porfyrin
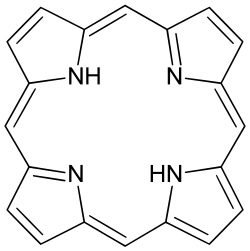
Porfyriner är en grupp kemiska föreningar, som ingår i ett flertal biologiska system, bland annat är de produkter i bildningen av hem och klorofyll. Porfyriner består huvudsakligen av kol- och väteatomer, men i de heterocykliska och aromatiska ringstrukturer som kolatomerna bildar ingår även kväveatomer. Grundstrukturen som är gemensam för alla porfyriner är en tetrapyrrolring som är sammanbunden med metenbryggor. Naturligt förekommande porfyriner kategoriseras genom antalet karboxylgrupper som är substituerade på ringstrukturen och varierar mellan två och åtta stycken. Uroporfyrin (åtta st syragrupper), coproporfyrin (4 st syragrupper) samt protoporfyrin IX (2 st syragrupper) är exempel på porfyriner som bildas vid hemsyntesen. Porfyriner är på grund av sin aromatiska ringstruktur, naturligt förekommande pigment och har fluorescerande egenskaper med absorptionsband mellan 390 och 425 nm.[1]
Ibland kan det uppstå defekter i de enzymer som medverkar i hemsyntesen vilket gör att höga halter av porfyriner ansamlas i kroppen och denna sjukdom heter porfyri.
Porfyriner kan binda till sig tvåvärda joner i mitten av ringstrukturen, tex Fe, Zn, Cu, Ni och Co. Porfyriner är ofta starkt purpurfärgade och härav kommer molekylens namn; det grekiska ordet πορφυρός (porphyros) betyder purpur.
I porfyrinets mitt binder den gärna en metallatom, såsom järn, zink, koppar, nickel eller kobolt. En typ av järnbindande porfyrin kallas hemgrupp och är en viktig beståndsdel i flera biologiska system däribland i blodets hemoglobin. Porfyrin finns även i klorofyll c[2] som förekommer hos kromalveolater. Övriga klorofyller bygger på klorin, som har en dubbelbindning mindre i en av pyrrolringarna än porfyrinerna.[3][2] Porfyriner har extremt höga molära ljusabsorptionskoefficienter, i storleksordningen 10^5 . Detta beror på porfyrinets utökade konjugerade elektronsystem. Porfyrin fungerar som kelatbildande ligand, vilket förmår komplexbinda exempelvis alkaliska jordartsmetaller
- ^ Lim, C.K. High performance liquid chromatography and mass spectrometry of porphyrins, chloraphylls and bilins
- ^ [a b] W Rüdiger, 2003, The Last Steps of Chlorophyll Synthesis i The Porphyrin Handbook, vol. 13, ISBN 0-12-393223-8, sid. 72.
- ^ Alexander V. Ruban, 2013, The Photosynthetic Membrane, John Wiley & Sons, ISBN 978-1-119-96054-6, sid. 82-86.
Previous Page Next Page


