
Back Benseen AF Benzeno AN بنزين (مركب كيميائي) Arabic Benzol AZ Бензол BA Benzene BCL Бензол BE Бэнзол BE-X-OLD Бензен Bulgarian বেনজিন Bengali/Bangla
| Bencenu | |
|---|---|
 | |
| Xeneral | |
| Estructura química |
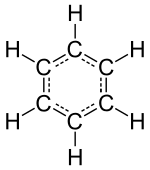 |
| Fórmula química | C₆H₆ |
| SMILES canónicu | modelu 2D |
| MolView | modelu 3D |
| Propiedaes físiques | |
| Masa | 78,046950192 unidá de masa atómica |
| Densidá absoluta | 0,88±0,01 gramu por centímetru cúbicu |
| Puntu de fusión | 42±1 Grau Fahrenheit, 6 grau Celsius, 5,53 grau Celsius |
| Puntu d'ebullición | 176±1 Grau Fahrenheit, 80 grau Celsius, 80,09 grau Celsius |
| Índiz de refraición | 1,501 |
| Velocidá del soníu | 1310±1 metru por segundu |
| Enerxía d'ionización | 9,24±0,01 electrón-voltiu, 9,25 electrón-voltiu |
| Capacidá calorífica | 16,157 xuliu por mol kelvin |
| Propiedaes termoquímiques | |
| Entalpía de formación | 82 930 xuliu por mol, 49 080 xuliu por mol |
| Entropía molecular estándar | 172,8±0,05 xuliu por mol kelvin |
| Peligrosidá | |
| Puntu d'inflamabilidá | 12±1 Grau Fahrenheit, −11±1 grau Celsius |
| Temperatura d'autoignición | 498±1 grau Celsius |
| Llímite inferior d'esplosividá | 1,2±0,1 porcentaxe en volume |
| Llímite superior d'esplosividá | 7,8±0,1 porcentaxe en volume |
| Identificadores | |
| IDLH | 1595±1 miligramu por metru cúbicu |
| 75±1 milímetru de mercuriu | |
El bencenu ye un hidrocarburu arumosu de fórmula molecular C6H6, (orixinariamente a él y los sos derivaos denominábense-y compuestos arumosos por cuenta de la forma carauterística que tienen) tamién ye conocíu como benzol. Nel bencenu cada átomu de carbonu ocupa'l vértiz d'un hexágonu regular, aparentemente trés de los cuatro valencies de los átomos de carbonu utilizar pa xunir átomos de carbonu allegante ente sigo, y la cuarta valencia con un átomu d'hidróxenu. Según les teoríes modernes sobre los enllaces químicos, trés de los cuatro electrones de la capa de valencia del átomu de carbonu utilícense direutamente pa formar los enllaces covalentes típicos (2C-C y C-H) y el cuartu compartir colos de los otros cinco átomos de carbonu, llográndose lo que se denomina "la nube π (pi)" que contién en diversos orbitales los seis electrones. El bencenu ye un líquidu incoloro y bien inflamable d'arume duce (que tien de remanase con sumu curiáu por cuenta del so calter canceríxenu), con un puntu de ebullición relativamente alto.
El bencenu usar en grandes cantidaes nos Estaos Xuníos. Atópase na llista de los 20 productos químicos de mayor volume de producción. Delles industries usen el bencenu como puntu de partida pa manufacturar otros productos químicos usaos na fabricación de plásticos, resines, nilón y fibres sintétiques como lo ye'l kevlar y en ciertos polímeros. Tamién s'usa bencenu pa faer ciertos tipos de gomes, llubricantes, tintures, deterxentes, melecines y pesticides. Los volcanes y quemes forestales constitúin fontes naturales de bencenu. El bencenu ye tamién un componente natural del petroleu crudu y la gasolina. Atópase tamién nel fumu de pitu y otros materiales orgánicos que se quemaron. Puede llograse por aciu la destilación fraccionada del alquitrán de hulla.
Suelse amosar, en términos d'estructura de Lewis, como un hexágonu, planu y indeformable, carente de tensiones d'aniellu (transanulares), en que los sos vértices atopar los átomos de carbonu, con trés dobles enllaces y trés enllaces simples en posiciones alternes (1=2, 3=4, 5=6; 6-1, 2-3, 4-5; o bien 1=2-3=4-5=6-1). Esta estructura difería de la de Brønsted y Lowry. Hai que resaltar que, acorde a los resultaos de la espectrofotometría infrarroxa, el bencenu nun tener nin simples nin dobles enllaces, sinón un híbridu de resonancia ente dambos, de distancia d'enllaz permediu ente simple y doble (aproximao 1,4 Å). Estos resultaos coinciden cola previsión de la TOM (teoría d'orbitales moleculares), que calcula una distribución de trés orbitales enlazantes totalmente ocupaos. A esta especial estabilidá llámase-y arumosidá y a les molécules (iones o non, estables o entemedios de reacción) llámase-yos arumoses.
