
Back يوبيكويتين Arabic Убиквитин Bulgarian Ubiqüitina Catalan Ubiquitin Czech Ubiquitin German Ουβικουιτίνη Greek Ubiquitin English Ubikvitino EO Ubicuitina Spanish Ubikvitiin ET
| Porodica ubikvitina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
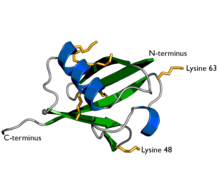 Dijagram ubikvitina. Sedam lizinskih bočnih lanaca prikazano je žuto /narandžasto | |||||||||
| Identifikatori | |||||||||
| Simbol | ubiquitin | ||||||||
| Pfam | PF00240 | ||||||||
| InterPro | IPR000626 | ||||||||
| PROSITE | PDOC00271 | ||||||||
| SCOP2 | 1aar / SCOPe / SUPFAM | ||||||||
| |||||||||
Ubikvitin (latinski: ubique praesentes = sveprisutno) je mali (8,6 kDa) regulatorni protein koji se nalazi u većini tkiva eukariotskih organizama, tj. nalazi se sveprisutno. Otkrio ga je Gideon Goldstein, 1975., a dalje je karakteriziran tokom kasnih 1970-ih i 1980-ih.[1] Ubikvitin u ljudskom genomu kodiraju četiri gena: UBB, UBC, UBA52 i RPS27A.
Dodatak ubikvitina supstratnom proteinu naziva se ubikvilacija (ili, alternativno, ubikvitinacija ili ubikvitinilacija). Ubikvilacija utiče na proteine na mnogo načina: može ih označiti za razgradnju putem proteasoma, promijeniti njihovu ćelijsku lokaciju, uticati na njihovu aktivnost i promovirati ili spriječiti proteinske interakcije. Uključuje tri glavna koraka: aktivaciju, konjugaciju i ligaciju, šro izvode ubikvitin-aktivirajući enzimi (E1s), ubikvitin-konjugirajući enzimi (E2s), odnosno ubikvitin-ligaza (E3s). Rezultat ove sekvencijske kaskade je vezanje ubikvitina na lizinske ostatke na proteinskoj podlozi putem izopeptidne veze, cisteinskih ostataka preko tioesterske veze, serinskih i treoninskih ostataka putem esterske veze ili amino grupa proteinskog N-kraja, putem peptidne veze.
Modifikacije proteina mogu biti ili jedan protein ubikvitina (monoubikvilacija) ili lanac ubikvitina (poliubikvitilacija). Sekundarne molekule ubikvitina su uvijek povezane sa jednim od sedam lizinskih ostataka ili N-terminalnim metioninom prethodne molekule ubikvitina. Ovi ostaci 'povezivanja' predstavljeni su s "K" ili "M" (jednoznačna oznaka aminokiselina lizina i metionina) i brojem, koji se odnosi na njegov položaj u molekuli ubikvitina kao u K48 , K29 ili M1. Prva molekula ubikvitina kovalentno je vezana preko C-terminalne karboksilatne grupe za određeni lizin, cistein, serin, treonin ili N-kraj ciljanog proteina. Poliubikvitilacija se javlja kada je C-kraj drugog ubikvitina povezan sa jednim od sedam ostataka lizina ili prvim metioninom na prethodno dodanoj molekuli ubikvitina, stvarajući lanac. Ovaj postupak se ponavlja nekoliko puta, što dovodi do dodavanja nekoliko ubikvitina. Samo poliubikvilacija na definiranim lizinima, uglavnom na K48 i K29, povezana je s razgradnjom putem proteasoma (naziva se "molekulski poljubac smrti"), dok su druge poliubikvilacije (npr. Na K63, K11, K6 i M1) i monoubikvitilacije mogu regulirati procese kao što su promet endocita, upala, translacija i popravak DNK.
Otkriće da lanci ubikvitina ciljaju proteine na proteasom, koji razgrađuje i reciklira proteine, počašćeno je Nobelovom nagradom za hemiju 2004. godine.[2][3][4]
- ^ Wilkinson KD (oktobar 2005). "The discovery of ubiquitin-dependent proteolysis". Proceedings of the National Academy of Sciences of the United States of America. 102 (43): 15280–2. Bibcode:2005PNAS..10215280W. doi:10.1073/pnas.0504842102. PMC 1266097. PMID 16230621.
- ^ Greška kod citiranja: Nevaljana oznaka
<ref>; nije naveden tekst za reference s imenompmid22524316 - ^ "The Nobel Prize in Chemistry 2004". Nobelprize.org. Pristupljeno 16. 10. 2010.
- ^ "The Nobel Prize in Chemistry 2004: Popular Information". Nobelprize.org. Pristupljeno 14. 12. 2013.