
Back ذيفان الخناق Arabic Toxina diftèrica Catalan Diphtheria toxin English Toxina diftérica Spanish Toxine diphtérique French Toxina diftérica GL Difterični toksin Croatian Tossina difterica Italian ジフテリア毒素 Japanese Difterijas toksīns Latvian/Lettish
| Diphtherietoxin (Corynephage β) | ||
|---|---|---|
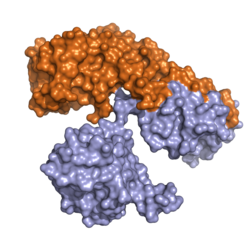
| ||
| Oberflächenmodell nach PDB 1DDT. Kette A (Enzym) orange, Kette B (Transporter) hellblau. | ||
| Masse/Länge Primärstruktur | 535 = 193+342 Aminosäuren | |
| Sekundär- bis Quartärstruktur | A+B | |
| Bezeichner | ||
| Gen-Name(n) | DT | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.4.2.36, Glycosyltransferase | |
| Reaktionsart | Übertragung eines ADP-Riboserests | |
| Substrat | NAD+ + EF-2 | |
| Produkte | NAD + EF-2(defekt) | |
Das Diphtherietoxin (DT) ist ein von 1884 bis 1889 von Loeffler, Roux und Yersin entdecktes[1] Exotoxin aus Corynebacterium diphtheriae, dem Erreger der Diphtherie und hemmt die Proteinbiosynthese bei Eukaryoten und Archaeen durch Blockierung der Translation während der Elongationsphase (mit Verlängerung der Aminosäurenkette). Das hochmolekulare und hitzelabile Toxin[2] zählt zu den Lektinen. Die genetische Information ist im Prophagen β (Corynebacterium-Phage beta) enthalten. Nur wenn das Bakterium von ihm infiziert wird, kann es selbst das Toxin bilden. Demnach können via Phagenkonversion (Infektion mit tox+-Phagen) nichttoxigene C. diphtheriae-Stämme die Fähigkeit, DT zu erzeugen, erwerben.[3][4][5]
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 48.
- ↑ Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 309.
- ↑ Diphtherie – RKI-Ratgeber. In: RKI. 10. Januar 2018, abgerufen am 2. Februar 2021.
- ↑ SIB: Viral exotoxin. Expasy: ViralZone
- ↑ SIB: Modulation of host virulence by virus. Expasy: ViralZone