Back مختزلة الريبونوكليوتيد Arabic Ribonucleòtid reductasa Catalan Ribonukleotidreduktáza Czech Ribonucleotide reductase English Ribonukleotidireduktaasi Finnish Ribonucléotide réductase French Ribonucleotide reduttasi Italian リボヌクレオシド二リン酸レダクターゼ Japanese Reduktaza rybonukleotydowa Polish Ribonucleotídeo redutase Portuguese
| Ribonukleotiddiphosphat-Reduktase, große Untereinheit | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 792 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer | |
| Bezeichner | ||
| Gen-Namen | RRM1 R1; RIR1; RR1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.17.4.1, Oxidoreduktase | |
| Reaktionsart | Reduktion einer Hydroxygruppe | |
| Substrat | Ribonukleotid-Diphosphat + Thioredoxin | |
| Produkte | Deoxyribonukleotid-Diphosphat + Thioredoxindisulfid + H2O | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Lebewesen[1] | |
| Ausnahmen | Archaea | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 6240 | 20133 |
| Ensembl | ENSG00000167325 | ENSMUSG00000030978 |
| UniProt | P23921 | P07742 |
| Refseq (mRNA) | NM_001033 | NM_009103 |
| Refseq (Protein) | NP_001024 | NP_033129 |
| Genlocus | Chr 11: 4.09 – 4.14 Mb | Chr 7: 102.44 – 102.47 Mb |
| PubMed-Suche | 6240 | 20133
|
| Ribonukleotiddiphosphat-Reduktase, kleine Untereinheit | ||
|---|---|---|

| ||
| Bändermodell des Dimer der R2-Untereinheit der Class I-RNR von Escherichia coli, nach PDB 1AV8 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 389 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Heterodimer | |
| Kofaktor | 2 Fe2+ | |
| Bezeichner | ||
| Gen-Namen | RRM2 R2; RR2; RR2M | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.17.4.1, Oxidoreduktase | |
| Reaktionsart | Reduktion einer Hydroxygruppe | |
| Substrat | Ribonukleotid-Diphosphat + Thioredoxin | |
| Produkte | Deoxyribonukleotid-Diphosphat + Thioredoxindisulfid + H2O | |
| Vorkommen | ||
| Homologie-Familie | RNR subunit M2 | |
| Übergeordnetes Taxon | Euteleostomi | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 6241 | 20135 |
| Ensembl | ENSG00000171848 | ENSMUSG00000020649 |
| UniProt | P31350 | P11157 |
| Refseq (mRNA) | NM_001034 | NM_009104 |
| Refseq (Protein) | NP_001025 | NP_033130 |
| Genlocus | Chr 2: 10.12 – 10.13 Mb | Chr 12: 24.71 – 24.71 Mb |
| PubMed-Suche | 6241 | 20135
|
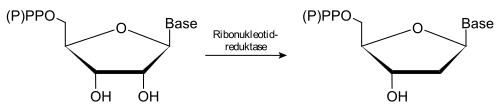
Die Ribonukleotidreduktase (oft auch als RNR abgekürzt) ist ein Enzym, welches das letzte Glied in der Kette der Synthese der DNA-Bausteine (Desoxynukleotide) bildet. Es reduziert, d. h. entfernt die Hydroxygruppe am Kohlenstoffatom C-2' des Ribose-Teils der Nukleotide. Substrate des Enzyms sind Ribonukleotid-phosphate, z. B. Adenosindiphosphat und Cytidindiphosphat, in Verbindung mit dem Kofaktor Thioredoxin.