
Back Waterstof AF Wasserstoff ALS ሀይድሮጅን AM Hidrocheno AN Wætertimber ANG हाइड्रोजन ANP هيدروجين Arabic هيدروجين ARY هايدروجين ARZ উদজান AS
| Eigenschaften | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Wasserstoff, H, 1 | ||||||||||||||||||||||||
| Elementkategorie | Nichtmetalle | ||||||||||||||||||||||||
| Gruppe, Periode, Block | 1, 1, s | ||||||||||||||||||||||||
| Aussehen | farbloses Gas (H2) | ||||||||||||||||||||||||
| CAS-Nummer |
| ||||||||||||||||||||||||
| EG-Nummer | 215-605-7 | ||||||||||||||||||||||||
| ECHA-InfoCard | 100.014.187 | ||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,9 % (9. Rang)[1] | ||||||||||||||||||||||||
| Atomar[2] | |||||||||||||||||||||||||
| Atommasse | 1,008 (1,00784–1,00811)[3][4] u | ||||||||||||||||||||||||
| Atomradius (berechnet) | 25 (53) pm | ||||||||||||||||||||||||
| Kovalenter Radius | 31 pm | ||||||||||||||||||||||||
| Van-der-Waals-Radius | 120 pm | ||||||||||||||||||||||||
| Elektronenkonfiguration | 1s1 | ||||||||||||||||||||||||
| 1. Ionisierungsenergie | 13.59843449(8) eV[5] ≈ 1312.05 kJ/mol[6] | ||||||||||||||||||||||||
| Physikalisch[2] | |||||||||||||||||||||||||
| Aggregatzustand | gasförmig (H2) | ||||||||||||||||||||||||
| Dichte | gasförmig: 0,0899 kg/m3 bei 273 K[7] flüssig: 0,0709 g/cm3 bei 20,324 K | ||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −2,2 · 10−9)[8] | ||||||||||||||||||||||||
| Schmelzpunkt | 14,01 K (−259,14 °C) | ||||||||||||||||||||||||
| Siedepunkt | 21,15 K[9] (−252 °C) | ||||||||||||||||||||||||
| Molares Volumen | fest: 11,42 · 10−6 m3·mol−1 | ||||||||||||||||||||||||
| Verdampfungsenthalpie | 0,90 kJ·mol−1[9] | ||||||||||||||||||||||||
| Schmelzenthalpie | 0,558 kJ·mol−1 | ||||||||||||||||||||||||
| Schallgeschwindigkeit | 1270 m·s−1 bei 298,15 K | ||||||||||||||||||||||||
| Spezifische Wärmekapazität | 14304 J·kg−1·K−1 | ||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,1805 W·m−1·K−1 | ||||||||||||||||||||||||
| Chemisch[2] | |||||||||||||||||||||||||
| Oxidationszustände | −1, ±0, +1 | ||||||||||||||||||||||||
| Normalpotential | 0 V (Referenz: 2 H+ + 2 e− ⇌ H2) | ||||||||||||||||||||||||
| Elektronegativität | 2,2 (Pauling-Skala) | ||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||
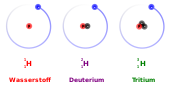
Wasserstoff ist ein chemisches Element mit dem Symbol H (für lateinisch Hydrogenium „Wasserbildner“) und der Ordnungszahl 1. Im Periodensystem steht das Element Wasserstoff in der 1. Periode und in der 1. IUPAC-Gruppe.
Wasserstoff ist mit einem Massenanteil von etwa 70 % das häufigste chemische Element im Universum, jedoch nicht auf der Erde, wo sein Massenanteil an der Erdhülle nur 0,87 % beträgt.[11]
Der Großteil des Wasserstoffs auf der Erde ist im Wasser gebunden, der Verbindung mit Sauerstoff, deren Masse zu 11 % aus Wasserstoff besteht. Wasserstoff kommt gebunden an andere Elemente in sämtlichen Pflanzen und lebenden Organismen vor. Wasserstoff ist ein fester Bestandteil fast aller organischen chemischen Substanzen.
Wasserstoff ist das chemische Element mit der geringsten Atommasse. Sein häufigstes Isotop, Protium, ist das einzige stabile Isotop ohne ein Neutron. Es besteht nur aus einem Proton und einem Elektron. Es existieren zwei weitere natürlich vorkommende Wasserstoffisotope, von denen das nicht-radioaktive Deuterium 0,0156 % des natürlichen Wasserstoffs ausmacht, während das in den oberen Schichten der Atmosphäre gebildete radioaktive Tritium nur in kleinsten Mengen vorkommt.[11][12]
Unter Bedingungen, die normalerweise auf der Erde herrschen (siehe Normalbedingungen), liegt das gasförmige Element Wasserstoff nicht als atomarer Wasserstoff mit dem Symbol H vor, sondern als molekularer Wasserstoff mit dem Symbol H2, als ein farb- und geruchloses Gas. Wenn z. B bei Redoxreaktionen Wasserstoff neu gebildet wird, tritt das Element vorübergehend atomar als H auf und wird als naszierender Wasserstoff bezeichnet. In dieser reaktiven Form reagiert Wasserstoff besonders gut mit anderen Verbindungen oder Elementen.
- ↑ Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Wasserstoff) entnommen.
- ↑ Angegeben ist der von der IUPAC empfohlene Standardwert, da die Isotopenzusammensetzung dieses Elements örtlich schwanken kann, ergibt sich für das mittlere Atomgewicht der in Klammern angegebene Massenbereich. Siehe: Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements 2009 (IUPAC Technical Report). In: Pure and Applied Chemistry. 2010, S. 1, doi:10.1351/PAC-REP-10-09-14.
- ↑ IUPAC, Standard Atomic Weights Revised 2013.
- ↑ Eintrag zu hydrogen in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST, Gaithersburg, MD. doi:10.18434/T4W30F (physics.nist.gov/asd). Abgerufen am 11. Juni 2020.
- ↑ Eintrag zu hydrogen bei WebElements, www.webelements.com, abgerufen am 11. Juni 2020.
- ↑ a b c Eintrag zu Wasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Oktober 2021. (JavaScript erforderlich)
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ Eintrag zu Hydrogen im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b Theodore L. Brown, H. Eugene LeMay, Bruce E. Bursten: Chemie. Die zentrale Wissenschaft. Pearson Studium, 2007, ISBN 978-3-8273-7191-1, S. 1087–1090.
- ↑ Jürgen Sültenfuß: Das Radionuklid Tritium im Ozean: Messverfahren und Verteilung von Tritium im Südatlantik und im Weddellmeer. Dissertation. In: Berichte zur Polarforschung. Nr. 256, 1998, 1.1 Das Isotop Tritium, S. 2–4, doi:10.2312/BzP_0256_1998 (awi.de [PDF]).

