
Back ۲-متیل-۲-بوتانول AZB 2-methylbutan-2-ol Czech 2-Methyl-2-Butanol Danish 2-Methyl-2-butanol German Tert-Amyl alcohol English ۲-متیل-۲-بوتانول FA 2-metyyli-2-butanoli Finnish 2-Méthylbutan-2-ol French Tert-Amil alkohol ID 2-メチル-2-ブタノール Japanese
| Bonvolu ne konfuzi... | |
 |
 |
| Ili estas izomeroj sed la unua prezentas la hidroksilon en la tria karbono de la amila kateno (sekundara karbono) dum la dua prezentas la hidroksilon sur terciara karbono. | |
| Terc-amila alkoholo | ||||
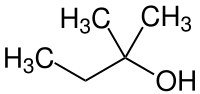 | ||||
| Plata kemia strukturo de la Terc-amila alkoholo | ||||
 | ||||
| Tridimensia kemia strukturo de la Terc-amila alkoholo | ||||
| Alternativa(j) nomo(j) | ||||
| ||||
| Kemia formulo | ||||
| CAS-numero-kodo | 75-85-4 | |||
| ChemSpider kodo | 6165 | |||
| PubChem-kodo | 6405 | |||
| Merck Index | 15,7253 | |||
| Fizikaj proprecoj | ||||
| Aspekto | senkolora likvaĵo kun kamforeca odoro | |||
| Molmaso | 88.1482 g·mol-1 | |||
| Denseco | 0.8084g cm−3 | |||
| Fandpunkto | -9 °C | |||
| Bolpunkto | 102.5 °C | |||
| Refrakta indico | 1,4052 | |||
| Ekflama temperaturo | 19 °C | |||
| Memsparka temperaturo | 425 °C[1] | |||
| Acideco (pKa) | 18.54 | |||
| Solvebleco | Akvo:118 g/L | |||
| Mortiga dozo (LD50) | 1000 mg/kg (buŝe) | |||
| Sekurecaj Indikoj | ||||
| Riskoj | R11 R20 R37/38 [2] | |||
| Sekureco | S46 | |||
| Pridanĝeraj indikoj | ||||
| Danĝero
| ||||
| GHS etikedigo de kemiaĵoj | ||||
| GHS Damaĝo-piktogramo |
| |||
| GHS Signalvorto | Damaĝo | |||
| GHS Deklaroj pri damaĝoj | H225, H312, H315, H318, H332, H335[3] | |||
| GHS Deklaroj pri antaŭgardoj | P210, P233, P240, P241, P242, P243, P261, P264, P271, P280, P302+352, P303+361+353, P304+312, P304+340, P305+351+338, P310, P312, P321, P332+313, P362, P363, P370+378, P403+233, P403+235, P405, P501 | |||
(25 °C kaj 100 kPa) | ||||
Terc-amila alkoholo aŭ 2-metil-2-butanolo estas branĉohava pentanolo uzata ĉefe kiel farmacia aŭ pigmenta solvanto. Ĝi estas senkolora likvaĵo kun kamforeca odoro, iomete solvebla en akvo kaj miksebla kun organikaj solvantoj.
Kvankam ĝi povas nature produktiĝi aŭ per fermentigo de la etanolo, ĝi estas ĉefe sintezita per hidroformiliigo. 2-metil-2-butanolo eksplode reakcias kun acetila bromido. Miksaĵo de ĉi-alkoholo kun koncentrita sulfata acido kaj hidrogena peroksido povas kaŭzi eksplodojn.
Alkilaj hipokloritoj estas forte eksplodemaj, kaj ili estas estigitaj per reakcio de alkoholoj kun natria hipoklorito, kaj en akvaj solvaĵoj, kaj miksitaj kun akvaj solvaĵoj de karbona tetraklorido. Kloro kaj 2-metil-2-butanolo simile estigas alkilajn hipokloritojn.
Ili malkomponiĝas eĉ malvarme kaj eksplodas kiam ekspoziciita al sunbrilo aŭ varmo. Same, reakcioj de izocianatoj kun alkoholoj devas efektiviĝi sub inertaj solvantoj. Tiaj reakcioj en foresto de solvantoj ofte okazas kun forta eksplodemo.





