
Back Ammoniumsulfaat AF كبريتات الأمونيوم Arabic Sulfatu d'amoniu AST Ammonium sulfat AZ آمونیوم سولفات AZB Амониев сулфат Bulgarian অ্যামোনিয়াম সালফেট Bengali/Bangla Sulfat d'amoni Catalan Síran amonný Czech Svovlsur ammoniak Danish
| Sulfate d'ammonium | |
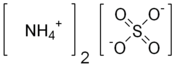 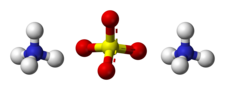 Structure du sulfate d'ammonium |
|
| Identification | |
|---|---|
| Synonymes |
sulfate d'ammoniaque ou ammoniaque sulfatée ; sel ammoniac vitriolique, alcali volatil |
| No CAS | |
| No ECHA | 100.029.076 |
| No CE | 231-984-1 |
| No E | E517 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores à l'état pur, blanc à gris |
| Propriétés chimiques | |
| Formule | (NH4)2SO4 |
| Masse molaire[1] | 132,14 ± 0,007 g/mol H 6,1 %, N 21,2 %, O 48,43 %, S 24,27 %, |
| Propriétés physiques | |
| T° fusion | décomposition en tube scellé sans air vers 280 °C, décomposition initié à l'air vers 150 °C, commune à 220 |
| Solubilité | dans l'eau, 754 g·L-1 à 20 °C, 764 g·L-1 à 25 °C, 941 g·L-1 à 80 °C |
| Masse volumique | 1,77 g·cm-3 à 20 °C |
| Cristallographie | |
| Système cristallin | Orthorhombique |
| Réseau de Bravais | orthorhombique |
| Classe cristalline ou groupe d’espace | Dipyramidale 2/m 2/m 2/m (holoédrie orthorhombique) ; Pnam |
| Paramètres de maille | a = 5,993 Å, b = 7.782 Å, c = 10,636 Å, Z = 4 |
| Macle | sur {101} |
| Propriétés optiques | |
| Indice de réfraction | nα = 1,521, nβ = 1,523, nγ = 1,533 (polyaxe) |
| Biréfringence | Biaxe (+) ; δ = 0,013 |
| Transparence | transparent à translucide, parfois opaque |
| Précautions | |
| SIMDUT[2] | |
Produit non contrôlé |
|
| Écotoxicologie | |
| DL50 | 3 000 mg·kg-1 (Rat ingestion) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfate d'ammonium est un corps composé chimique ionique de formule (NH4)2SO4. Il s'agit d'un sel d'ammonium NH4+ et d'acide sulfurique H2SO4 qui possède de très nombreuses applications. Il existe dans la nature, sous le nom minéralogique de mascagnite.
Il est notamment couramment utilisé comme engrais destiné à l'acidification des sols alcalins ; il contient 21 % d'azote sous forme d'ammonium NH4+ et 24 % de soufre sous forme de sulfate SO42−. Il est aussi utilisé pour accélérer le départ en fermentation des moûts. On peut ajouter 10 g/hL de (NH4)2SO4 lorsque la teneur du moût en azote ammoniacal est inférieure à 50 mg·L-1.
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ « Sulfate d'ammonium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009