
Back مستوى طاقة Arabic Nivel enerxéticu AST Энергетычны ўзровень BE Енергетично ниво Bulgarian Energetski nivo BS Nivell d'energia Catalan Энергилле шай CV Energiniveau Danish Energieniveau German Energy level English





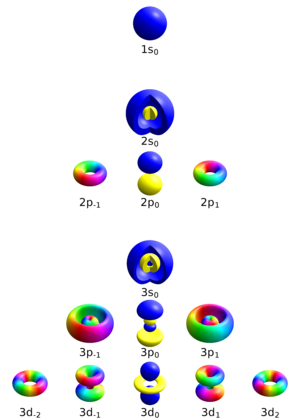

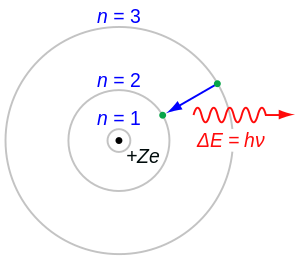

Energijske razine su bliske diskretne razine (nivoi) energije u nekom izoliranom sustavu (atom, molekula) ili u nekome sustavu čestica. U fizici čvrstoga stanja (Fermijev plinski model slobodnih elektrona, teorija elektronskih vrpci u kristalima), gustoća atoma i gustoća energijskih razina golema je, oko 1026 atoma/kg ili oko 1028 atoma/m³. Kada se atomi počinju približavati i stvarati kristalnu rešetku, energijske razine pojedinačnih atoma cijepaju se i spajaju u vrpce ili pojase dopuštenih energija. Energijska razina u metalu ili poluvodiču opisana je glavnim kvantnim brojem n i dvjema orijentacijama spina ("spin-gore" i "spin-dolje"), pri čemu je svaka orijentacija zasebno stanje zbog Paulijeva načela. Prema tome, N elektrona u metalu (N je paran) rasporedit će se na:
energijskih razina, jer će u svakoj razini biti po dva elektrona. Dakle, broj stanja (elektrona) N dvostruko je veći od broja razina n:
Čestice se u sustavu naseljavaju (razmještaju) po razinama kao razlučive (klasična Maxwell-Boltzmannova statistika) ili kao nerazlučive čestice u skladu s načelima kvantnih statistika: Fermi-Diracovoj i Bose-Einsteinovoj.[1]

