
Back هيدريد الصوديوم Arabic سودیوم هیدرید AZB Натриев хидрид Bulgarian সোডিয়াম হাইড্রাইড Bengali/Bangla Hidrur de sodi Catalan Hydrid sodný Czech Natriumhydrid Danish Natriumhydrid German Υδρίδιο του νατρίου Greek Sodium hydride English
| Idruro di sodio | |
|---|---|
 | |
| Nome IUPAC | |
| idruro di sodio | |
| Nomi alternativi | |
| sodio idruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | NaH |
| Massa molecolare (u) | 24 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| Numero EINECS | 231-587-3 |
| PubChem | 24758 |
| SMILES | [H-].[Na+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,20 |
| Solubilità in acqua | reagisce con l'acqua, insolubile in solventi organici |
| Temperatura di fusione | 800 °C (1073,15 K) con decomposizione |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 228 - 260 - 314 |
| Consigli P | 210 - 223 - 231+232 - 280 - 370+378 - 422 [1][2] |
L'idruro di sodio è un composto chimico cristallino con formula NaH. È infiammabile ed instabile all'aria. Reagisce violentemente con l'acqua secondo la reazione
generando idrogeno altamente infiammabile ed esplosivo in miscela con l'aria.
L'uso principale dell'idruro di sodio sfrutta la qualità di base forte applicata alla sintesi organica. NaH è un principale rappresentante degli idruri salini, caratterizzati da legame ionico, che hanno proprietà chimico-fisiche e reattività differenti rispetto agli idruri covalenti tipo borano, metano, ammoniaca ed acqua.
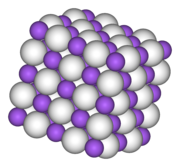
NaH viene prodotto per reazione diretta, sfruttante l'elevata elettropositività del sodio, tra idrogeno e sodio fuso. L'idruro di sodio cristallizza, come tutti gli idruri dei metalli alcalini, nel sistema cubico a facce centrate con ogni ione Na+ circondato da sei H-. Il composto puro è incolore, tende ad assumere colorazione grigia.
L'idruro di sodio viene comunemente commercializzato sotto forma di sospensione in olio minerale al 60% in peso, stato fisico che ne permette di preservare la stabilità. Le reazioni implicanti l'utilizzo di NaH vengono condotte in atmosfera inerte, ad esempio in atmosfera d'azoto.
- ^ scheda dell'idruro di sodio su IFA-GESTIS
- ^ In caso di incendio, estinguere con biossido di carbonio.
