
Back Nitronium AF أيون النترونيوم Arabic Nitronium Czech Nitroniumion German Nitronium ion English Ion nitronium French Nitrilkation Hungarian Ion nitronium ID ニトロニウムイオン Japanese ნიტრონიუმის იონი KA
| Ione nitronio | |
|---|---|
 | |
| Nome IUPAC | |
| Diossidoazoto(1+)[1] | |
| Caratteristiche generali | |
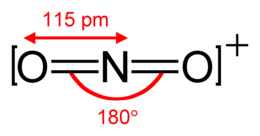
| Formula bruta o molecolare | NO2⁺ |
| Massa molecolare (u) | 46.01 g·mol−1 |
| Numero CAS | |
| PubChem | 3609161 |
| SMILES | [N+](=O)=O |
| Proprietà termochimiche | |
| S0m(J·K−1mol−1) | 233.86 J K−1 mol−1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| attenzione | |
Lo ione nitronio è un catione di formula chimica NO2+ è generalmente molto instabile e prodotto dalla rimozione di un elettrone dal paramagnetico diossido di azoto, o dalla protonazione dell'acido nitrico seguita dall'eliminazione di una molecola di acqua.
Non è abbastanza stabile per esistere alle condizioni normali, ma è usato estensivamente come un elettrofilo nella nitrazione di substrati aromatici e anche di altre sostanze. Lo ione è generato, quando torna utile, miscelando acido solforico (acido più forte) e acido nitrico (che si comporterà da base) secondo questa reazione:
- H2SO4 + HNO3 → HSO4− + H2O+–NO2 → HSO4− + NO2+ + H2O
Lo ione nitronio è contenuto nel pentossido di diazoto (N2O5) allo stato solido, che è un composto ionico formato da ioni nitronio e ioni nitrato, mentre allo stato liquido o in soluzione di solventi non protici (CCl4, CHCl3, POCl3 e simili) e allo stato gassoso ha forma molecolare (O2N-O-NO2). Lo ione nitronio è isoelettronico con l'anidride carbonica CO2, con l'ossido di diazoto N2O e con lo ione metaborato BO2– e,come in questi, l'atomo centrale è ibridato sp e la struttura O–N–O è lineare con angoli di 180°.
Lo ione contenente gli stessi atomi, ma con carica negativa, NO−2, è lo ione nitrito.
- ^ dioxidonitrogen(1+) (CHEBI:29424), in Chemical Entities of Biological Interest (ChEBI), UK, Istituto di Bioinformatica Europeo.

