
Back Neutron AF Neutron ALS Neutrón AN نيوترون Arabic نيوطرون ARY নিউট্ৰন AS Neutrón AST Neytron AZ نوترون AZB Neutruons BAT-SMG
 | |
| Klasifikacija: | Barion |
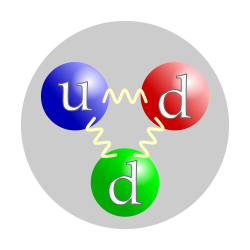
| Kompozicija: | 1 gornji kvark, 2 donja kvarka |
| Čestična statistika: | Fermion |
| Grupa: | Hadron |
| Međudjelovanje: | Gravitacijsko, slabo, jako, elektromagnetsko |
| Simbol(i): | n, n0, N0 |
| Antičestica: | Antineutron |
| Teoretiziran: | Ernest Rutherford (1920.) |
| Otkriven: | James Chadwick (1932.) |
| Masa: | 1,674927471(21)× −27 kg |
| Vrijeme poluraspada: | 881,5(15) s |
| Električni naboj: | 0 e |
| Electric dipole moment: | < 2,9×10−26 e⋅cm (gornja granica pokusa) |
| Electrična polarizabilnost: | 1,16(15)×10−3 fm3 |
| Magnetski moment: | −0,96623650(23)×10−26 J·T−1 −1,04187563(25)×10−3 μB |
| Magnetska polarizabilnost: | 3,7(20)×10−4 fm3 |
| Spin: | 1⁄2 |
| Izospin: | -1⁄2 |
| Paritet: | +1 |
U fizici, neutron je subatomska čestica, simbol n ili n0
, bez naelektrisanja i sa masom od 940 MeV/c 2 (1.6749 h 10−27 kg, malo većom od mase protona). Njegov spin je 1/2. Neutron je sastavni deo jezgra svakog atoma osim najrasprostranjenijeg izotopa vodonika, čije se jezgro sastoji samo od jednog protona. Kako se protoni i neutroni slično ponašaju unutar jezgra, i svaki ima masu od aproksimativno jedne jedinice atomske mase, oni se nazivaju nukleonima.[3] Njiova svojstva i interakcije opisuje nuklearna fizika.
Hemijska i nuklearna svojstva nukleusa su određena brojem protona, koji se naziva atomski broj, i brojem neutrona, zvanim neutronski broj. Atomski maseni broj je ukupni broj nukleona. Na primer, ugljenik ima atomski broj 6, i njegov široko zastupljeni izotop ugljenik-12 ima 6 neutrona,[4] dok njegov retki izotop ugljenik-13 ima 7 neutrona. Neki elementi se javljaju u prirodi sa samo jednim stabilnim izotopom, kao što je fluor. Drugi elementi imaju više stabilnih izotopa, kao što je kalaj sa deset stabilnih izotopa.
Unutar nukleusa, protoni i neutroni su međusobno vezani putem nuklearne sile. Neutroni su neophodni za stabilizaciju jezgra. Jedini izuzetak je jednoprotonski atom vodonika. Neutroni se izobilno formiraju u nuklearnoj fisiji i fuziji. Oni su primarni doprinosilac nukleosintezi hemijskih elemenata unutar zvezda putem fisije, fuzije i procesa neutronskog zarobljavanja.
Neutron je esencijalan u produkciji nuklearnog goriva. U deceniji nakon što je neutron otkrio Džejms Čedvik 1932. godine,[5] neutroni su korišteni za uvođenje raznih tipova nuklearnih transmutacija. Sa otkrićem nuklearne fuzije 1938. godine,[6] brzo je shvaćeno da, ako događaj fisije proizvodi neutrone, svaki od tih neutrona može da izazove dalje događaje fisije, itd., u kaskadi poznatoj kao nuklearna lančana reakcija.[7] Ovi događaji i nalazi su doveli do prvog samoodrživog nuklearnog reaktora (Čikaška kamara-1, 1942) i prvog nuklearnog oružja (Triniti, 1945).
Slobodni neutroni, mada direktno ne jonizuju atome, uzrokuju jonizujuću radijaciju. Kao takvi oni mogu da budu biološki hazard, u zavisnosti od doze.[7] Mali prirodni fluks „neutronske pozadine” slobodnih neutrona postoji na Zemlji, uzrokovan zasipanjem kosmičkim zračenjem, i prirodnom radioaktivnošću spontano fizionih elemenata u Zemljinoj kori.[8] Namenski neutronski izvori kao što su neutronski generatori, istraživački reaktori i spalacioni izvori uzrokuju oslobađanje slobodnih neutrona za upotrebu u iradijaciji i u eksperimentima neutronskog rasejavanja.
- ↑ Mohr, P.J.; Taylor, B.N. and Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" (Web Version 7.0). The database was developed by J. Baker, M. Douma, and S. Kotochigova. (2014). National Institute of Standards and Technology, Gaithersburg, Maryland 20899.
- ↑ Olive, K.A.; (Particle Data Group); et al. (2014). "Review of Particle Physics" [1]
- ↑ The Structure of the Nucleon, Wiley-WCH, Berlin, 2001, ISBN 978-3-527-40297-7
- ↑ „Table of Isotopic Masses and Natural Abundances” (PDF). 1999.
- ↑ Chadwick, James (1932). „Possible Existence of a Neutron”. Nature 129 (3252): 312. Bibcode 1932Natur.129Q.312C. DOI:10.1038/129312a0.
- ↑ Hahn, O. & Strassmann, F. (1939). „Über den Nachweis und das Verhalten der bei der Bestrahlung des Urans mittels Neutronen entstehenden Erdalkalimetalle ("On the detection and characteristics of the alkaline earth metals formed by irradiation of uranium with neutrons")”. Naturwissenschaften 27 (1): 11-15. Bibcode 1939NW.....27...11H. DOI:10.1007/BF01488241.. The authors were identified as being at the Kaiser-Wilhelm-Institut für Chemie, Berlin-Dahlem. Received 22 December 1938.
- ↑ 7,0 7,1 Greška u referenci: Nevaljana oznaka
<ref>; nije zadan tekst za reference po imenuENW - ↑ Carson, M. J. (2004). „Neutron background in large-scale xenon detectors for dark matter searches”. Astroparticle Physics 21 (6): 667-687. arXiv:hep-ex/0404042. Bibcode 2004APh....21..667C. DOI:10.1016/j.astropartphys.2004.05.001.