Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Dimethylamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
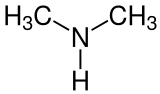
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H7N | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit fisch- bzw. ammoniakartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 45,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Dichte |
0,67 g·cm−3 (beim Siedepunkt v. 7 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
7 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
10,73 (25 °C, konjugierte Säure)[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−18,8 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dimethylamin (nach IUPAC-Nomenklatur: N-Methylmethanamin, abgekürzt auch als DMA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der sekundären aliphatischen Amine. Es kommt als 40%ige wässrige Lösung, 33%ige Lösung in Ethanol und als druckverflüssigtes Gas in den Handel.
- ↑ a b c d e f g h i j k l Eintrag zu Dimethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. März 2019. (JavaScript erforderlich)
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-91.
- ↑ Eintrag zu Dimethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. März 2019.
- ↑ Eintrag zu Dimethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. März 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 124-40-3), abgerufen am 4. Januar 2025.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
Previous Page Next Page






