Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
Zwitterion
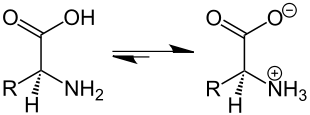
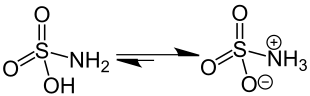
Ein Zwitterion (siehe auch Ion) ist ein Molekül mit zwei oder mehreren funktionellen Gruppen, von denen eine positiv und eine andere negativ geladen ist. Besitzt ein Zwitterion beispielsweise zwei funktionelle Gruppen mit entgegengesetzten Ladungen, so ist das Molekül (am isoelektrischen Punkt) insgesamt elektrisch neutral.[1] Teilweise wird auch der Begriff „inneres Salz“ für ein Zwitterion verwendet.
Meist handelt es sich bei den Gruppen um eine Säure- und eine Basenfunktion. Das bekannteste Beispiel sind Aminosäuren,[2] die sowohl in wässriger Lösung als auch in der festen Phase zwitterionisch vorliegen. Die Carboxygruppe gibt ein Wasserstoffion ab und trägt eine negative Ladung, die Aminogruppe nimmt ein Wasserstoffion auf und trägt eine positive Ladung. Im Unterschied zu Betainen lassen sich die Ladungen also durch Protonenwanderung ausgleichen.
In Lösung sind bei einem bestimmten pH-Wert, dem isoelektrischen Punkt, gleich viele Carboxygruppen, zu (negativ geladen) Carboxylatgruppen deprotoniert wie Aminogruppen zu (positiv geladenen) Ammoniumgruppen protoniert worden sind, positiv.[3] Dann wandern Aminosäuren im elektrischen Feld nicht mehr, sondern richten sich nur aus, da die Summenladung neutral ist. Liegt der pH-Wert unter dem isoelektrischen Punkt, nimmt die Dissoziation der Carboxygruppe ab, und die Aminosäure trägt eine positive Summenladung. Liegt der pH-Wert darüber, nimmt die Dissoziation der Carboxygruppe zu, und das Molekül trägt eine negative Summenladung. Diesen Effekt nutzt man bei der Elektrophorese und bei der isoelektrischen Fokussierung. Am isoelektrischen Punkt ist die Wasserlöslichkeit von Aminosäuren am geringsten, da aufgrund der entstandenen intramolekularen Ladungen keine stabile Hydrathülle mehr gebildet werden kann. Einige Aminosäuren tragen mehr als zwei Ladungen und können gemischte Salze bilden,[4] bei denen die H-Brückensysteme variieren können, was zusätzliche Erkennungsmöglichkeiten bietet.
Bei Peptiden und Proteinen sind die Verhältnisse analog zu denen bei den Aminosäuren. Von einer Carboxygruppe des Peptids oder Proteins wandert ein Proton zu einer basischen Aminogruppe, die am N-terminalen Ende stehen kann, aber nicht zwingend stehen muss.
- ↑ Eintrag zu zwitterionic compounds/zwitterions. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.Z06752 – Version: 2.1.5.
- ↑ Olaf Kühl: Organische Chemie. Wiley-VCH, Weinheim, 2012, S. 242, ISBN 978-3-527-33199-4.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich, 2006, S. 371, ISBN 978-3-906390-29-1.
- ↑ Anton P. Novikov, Alexey V. Safonov, Konstantin E. German, Mikhail S. Grigoriev: What kind of interactions we may get moving from zwitter to “dritter” ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate. In: CrystEngComm. 1. Dezember 2023, doi:10.1039/D3CE01164J.
Previous Page Next Page


