Our website is made possible by displaying online advertisements to our visitors.
Please consider supporting us by disabling your ad blocker.
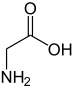
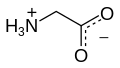
Glicina
| Glicina Alerta sobre risco à saúde[1] | |
|---|---|
|
|
|
|
| Nome IUPAC | Glicina Ácido 2-aminoacético |
| Outros nomes | Ácido aminoetanóico |
| Identificadores | |
| Abreviação | Gly, G |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| Propriedades | |
| Fórmula química | C2H5NO2 |
| Massa molar | 75.06 g mol-1 |
| Aparência | sólido branco |
| Densidade | 1,1607 g/cm3 |
| Ponto de fusão |
233 °C (decomposição) |
| Solubilidade em água | 25 g/100 mL |
| Solubilidade | solúvel em etanol, piridina insolúvel em éter |
| Acidez (pKa) | 2,32 |
| Riscos associados | |
| LD50 | 2600 mg/kg (ratos, oral) |
| Compostos relacionados | |
| Aminoácidos relacionados | Alanina (2-amino-propanoico) Beta-alanina (3-amino-propanoico) Alfa-fenilglicina Sarcosina (N-metil glicina) |
| Compostos relacionados | Ácido carbâmico (NH2COOH) Ácido glicólico (hidroxiacético) Etanolamina |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A glicina (do grego glykos, "doce", nome devido ao seu sabor adocicado[2]) é um dos aminoácidos codificados pelo código genético, sendo, portanto, um dos componentes das proteínas dos seres vivos. É codificado pelos codões GGU, GGC, GGA e GGG[3].
Devido à sua simplicidade estrutural, este aminoácido tende a ser conservado evolucionariamente em proteínas como o citocromo c, a mioglobina e a hemoglobina. A glicina é o único aminoácido que não apresenta actividade óptica. A maioria das proteínas possui pequenas quantidades de glicina; o colagénio é uma excepção de nota, constituindo a glicina cerca de um terço da sua estrutura primária. A presença de glicina inibe a formação de alfa-hélices mas facilita a formação de folhas-beta na estrutura secundária de proteínas, por ser um aminoácido que apresenta um alto grau de flexibilidade quando integrado numa cadeia polipeptídica.[2]
Apesar de ser um aminoácido apolar, a sua cadeia lateral (um átomo de hidrogênio) é demasiado curta para participar em interações hidrofóbicas.[2] No entanto, a glicina pode, em determinadas enzimas como a piruvato:formato liase, ser convertida a radical glicilo através da retirada desse átomo de hidrogênio, sendo este radical importante para a catálise enzimática, embora instável e destruído na presença de O2.
- ↑ Merck Index, 11th Edition, 4386.
- ↑ a b c Nelson 2004.
- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. «Nomenclature and Symbolism for Amino Acids and Peptides». Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Consultado em 17 de maio de 2007
Previous Page Next Page


