Back Metanol AF ميثانول Arabic মিথানল AS Metanol AST Metanol AZ متانول AZB Метанол BE Метанол Bulgarian মিথানল Bengali/Bangla Metanol BS
| |||
| |||
| Imena | |||
|---|---|---|---|
| Sistematično ime
metanol[1] | |||
| Druga imena
hidroksimetan
metilni alkohol metil hidrat metilni hidroksid metilol lesni alkohol | |||
| Identifikatorji Napaka v predlogi * neznano ime parametra (Predloga:Chembox Identifiers): "PubChem_Ref" (Glej seznam parametrov). To sporočilo se izpiše le v Predogled, ne bo se izpisalo po Objavi spremembe.
| |||
3D model (JSmol)
|
|||
| 3DMet | |||
| 1098229 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.599 | ||
| EC število |
| ||
| Gmelin | 449 | ||
| KEGG | |||
| MeSH | Methanol | ||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
| UN število | 1230 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| CH4O | |||
| Molska masa | 32,04 g·mol−1 | ||
| Videz | brezbarvna kapljevina | ||
| Gostota | 0,7918 g/cm3 | ||
| Tališče | −97,6 °C (−143,7 °F; 175,6 K) | ||
| Vrelišče | 64,7 °C (148,5 °F; 337,8 K) | ||
| log P | -0,69 | ||
| Parni tlak | 13,02 kPa (pri 20 °C) | ||
| Kislost (pKa) | 15,5[2] | ||
| Lomni količnik (nD) | 1,33141[3] | ||
| Viskoznost | 5,9×10−4 Pa s (pri 20 °C) | ||
| Dipolni moment | 1,69 D | ||
| Nevarnosti Napaka v predlogi * neznano ime parametra (Predloga:Chembox Hazards): "Reference; EUIndex; Autoignition" (Glej seznam parametrov). To sporočilo se izpiše le v Predogled, ne bo se izpisalo po Objavi spremembe.
| |||
EU klasifikacija (DSD) (zastarelo)
|
|||
| R-stavki (zastarelo) | R11, R23/24/25, Predloga:R39/23/24/25 | ||
| S-stavki (zastarelo) | (S1/2), S7, S16, S36/37, (S45) | ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 11–12 °C | ||
| Meje eksplozivnosti |
36% | ||
| Sorodne snovi | |||
| Sorodne snovi | metanetiol | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
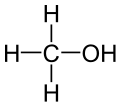
Metanol je spojina s formulo CH3OH, najenostavnejši alkohol, ki je pri sobnih pogojih lahko hlapna, brezbarvna in vnetljiva kapljevina, s podobno, a nekoliko slajšo aromo kot etanol.[5]
Spojina nastaja naravno kot stranski produkt anaerobnega metabolizma nekaterih bakterij, zato je v majhnih količinah prisoten v obliki hlapov v ozračju. V preteklosti so ga pridobivali s suho destilacijo lesa, zato je dobil ljudsko ime »lesni alkohol«, danes pa ga industrijsko pridobivajo predvsem z reakcijo ogljikovega oksida in vodika, katalizirano z zmesjo bakra in cinkovega ter aluminijevega oksida:
- CO + 2 H2 → CH3OH
V prisotnosti kisika oksidira (zgori) v ogljikov dioksid in vodo:
- 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
Največji delež metanola uporabljamo v proizvodnji formaldehida, v manjši meri pa kot gorivo za motorje z notranjim zgorevanjem (neposredno ali pretvorjenega v biodizel), topilo in antifriz.
V človekovih prebavilih se metabolizira v mravljinčno kislino in njene soli, ki so strupene za osrednje živčevje, lahko povzročijo oslepitev ali celo nezavest in smrt. Industrijskemu etanolu za domače potrebe (razkuževanje ipd.) zato proizvajalci dodajajo metanol, da bi preprečili uživanje in se izognili regulacijam za alkoholne pijače. Taki zmesi pravimo denaturirani alkohol.
- ↑ »Methanol«. The PubChemProject. USA: National Center for Biotechnology Information.
- ↑ Ballinger, P.; Long, F.A. (1960). »Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds«. J. Am. Chem. Soc. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ↑ Refractive index of Methanol, CH3OH (MeOH) [LIQUIDS] - RefractiveIndex.INFO
- ↑ »The Emergency Response Safety and Health Database: Systematic Agent: METHANOL«. Centers for Disease Control and Prevention. Pridobljeno 26. avgusta 2009.
- ↑ National Institute for Occupational Safety and Health (22. avgust 2008). »The Emergency Response Safety and Health Database: Methanol«. Pridobljeno 17. marca 2009.